Bases Biológicas de la Esmoltificación
Luis Vargas-Chacoff1, Alejandro Yáñez2, Jorge Mancilla3, Hans Kossmann4, Francisco J. Morera5.1Instituto de Ciencias Marinas y Limnológicas, Universidad Austral de Chile, Valdivia, Chile.2Instituto de Bioquímica y Microbiología, Interdisciplinary Center for Aquaculture Research (Fondap-Incar), Universidad Austral de Chile, Valdivia, Chile.3Marine Harvest Chile; Ruta 226 km 8, Tepual; Puerto Montt4Asesorías e Inversiones Trapananda LTDA, Puerto Montt5Instituto de Farmacología y Morfofisiología, Universidad Austral de Chile, Valdivia, Chile.Autor de correspondencia: luis.vargas@uach.cl
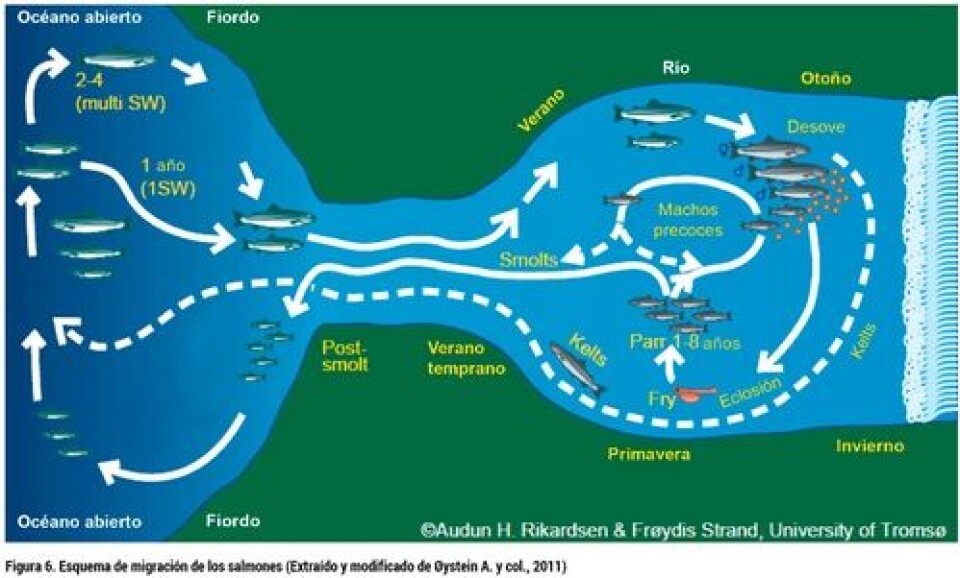
1. Etología de la Esmoltificación (Estrategias de vida en salmónidos: anadromía) La esmoltificación es una de las etapas más importantes dentro del proceso productivo de los salmones. Algunos productores del rubro consideran esta etapa como el “cuello de botella” de la producción, lo cual hace referencia a la gran cantidad de individuos que mueren o retrasan su crecimiento al ser trasladados al mar debido a no terminar la esmoltificacion de manera exitosa. En gran medida el éxito de la industria salmonicultora en términos de eficiencia, entre otros aspectos depende de la obtención de ejemplares “smolt” de calidad. La esmoltificación consiste en una serie de cambios independientes, pero coordinados para desarrollar procesos bioquímicos, fisiológicos, morfológicos y conductuales que permiten a un salmón juvenil prepararse para su vida en agua de mar. En estos animales, específicamente, ocurre un cambio en el metabolismo de los lípidos, transporte de oxígeno, flotabilidad, crecimiento, color, forma y por supuesto cambios a nivel de la osmorregulación (McCormick 1998). Es importante mencionar que la esmoltificación es un proceso reversible y por ende es muy importante que el pez pueda hacer ingreso al ambiente marino en el momento oportuno y seguir su vida biológico-productiva. En primer lugar, es importante entender el comportamiento y la biología de las especies a estudiar. En este caso, nos centraremos en los “salmonídeos” en general y con especial énfasis en el salmón Atlántico (Salmo salar). Lo primero que se debe tener en cuenta es que el salmón Atlántico es considerado una especie “anádroma”, palabra originaria del griego “anadramein”, que según su etimología se divide en “ana” (arriba) y “dramein” (carrera), lo cual quiere decir que pasan la mayor parte del tiempo en el mar y finalmente migran al río (arriba), para poder reproducirse, donde nuevamente comienza el ciclo y así los nuevos individuos van desde el agua del río hasta el mar (Fig. 6).

Este proceso en ambiente natural hace que los salmones pasen en promedio 2,5 años en agua dulce y alrededor de 2 o más años en agua salada (McCormick, 1998; McDowell, 2007). Para poder migrar desde un medio hipotónico (agua dulce) a un medio hipertónico (agua salada) es necesario que los peces cambien su fisiología, y es así que nace el término “esmoltificación”. Éste se define como el proceso mediante el cual los peces “parr” (éstos se caracterizan por poseer manchas de color café) cambian a “smolt”, éstos últimos se vuelven más plateados (Fig. 7). Esto se produce debido al catabolismo de proteínas, donde se genera acumulación de guanina e hipoxantina en la piel y las escamas que cubren dichas marcas y dan el color plateado a los smolt, además experimentalmente se comprobó que añadiendo tiroxina (T4) al agua esta hormona tiroidea está involucrada en este cambio color de los peces (Wedemeyer y col., 1980; McCormick y col., 1998). Además de este cambio de color de los peces, existen una serie cambios fisiológicos-endocrinos que se relacionan con este proceso y que veremos más adelante. Dentro de esta migración río abajo-mar-río arriba se acuña otro término: “imprinting”, éste alude al hecho que los salmones vuelven a su río natal con alta precisión. Este fenómeno es dependiente de ciertos sistemas, como lo es el olfatorio. A modo de entender de manera simple cómo funciona el sistema olfatorio de los salmones, podemos señalar que éste está compuesto por estructuras llamadas “rosetas olfatorias”, que son órganos sensoriales ubicados en las fosas nasales, además, poseen un nervio olfatorio y el bulbo olfatorio, éstos reconocen las huellas o señales olfatorias donde los salmones vuelven desde el mar a los ríos para reproducirse (ver McCormick, 2013).

2. Control hormonal de la esmoltificación El control neuroendocrino de los mecanismos adaptativos a nuevos ambientes, implica un alto número de hormonas, tanto hipofisarias como extrahipofisarias. En la adenohipófisis los teleósteos sintetizan y liberan diversas hormonas implicadas en procesos de osmorregulación, crecimiento, reproducción, etc. (Norris, 1997). Entre estas hormonas encontramos las hormonas de la famila GH/PRL (prolactina [PRL] y hormona del crecimiento [GH]), cortisol, tiroideas, por nombrar algunas de las más relevantes, que además serán tratadas en este estudio (para mayor detalle ver McCormick, 2013).
Prolactina (PRL) La PRL está considerada como una hormona promotora de la adaptación a ambientes hipoosmóticos (agua dulce) en teleósteos. Esta hormona estimula la secreción de mucus, incrementando el tamaño de esta capa y reduciendo el tránsito de iones y de agua a través de ella, es decir, el mucus actúa como barrera para evitar la pérdida de iones además de ser una barrera inmunológica. Ejemplos de salmónidos donde se ha visto que la expresión de PRL incrementa cuando los peces pasan desde agua salada a agua dulce tenemos a el salmón chum (Oncorhynchus keta), salmón rojo (Oncorhynchus nerka), salmón amago (Oncorhynchus rhodurus), en trucha arcoíris (Oncorhynchus mykiss), salmón Atlántico (Salmo salar) y en teleósteos en general (Onuma y col., 2010; McKeown, 1972; Yada y col., 1992; Prunet y Boeuf, 1985; Power, 2005). Sakamoto y McCormick (2006) han sugerido que el control celular (apoptosis o proliferación celular) en diferentes epitelios osmorreguladores (branquias, intestino, etc.) es una función dependiente de la PRL. La prolactina también inhibe algunos de los mecanismos asociados con aumentos en la secreción de sal, como es la liberación de GH (hormona de crecimiento), cortisol y niveles de la actividad de la bomba Na+, K+-ATPasa (NKA), e incluso la transcripción de la sub-unidad NKA “1b” que está asociada con la aclimatación a agua salada (Seidelin y Madsen, 1997; Tipsmark y Madsen, 2009). Por este motivo, esta hormona presenta un importante papel osmorregulador en los teleósteos dulceacuícolas y en los eurihalinos mantenidos en ambientes hipoosmóticos (Bern, 1975; Hirano, 1986; McCormick, 1995; Manzon, 2002; Mancera y McCormick, 2007).
Hormona de crecimiento (GH) La GH regula, entre otras funciones, tanto el metabolismo intermediario como los mecanismos osmorreguladores de teleósteos. Esta acción se realiza de una manera directa o bien de una manera indirecta a través de las denominadas somatomedinas (del inglés insulin growth factors: IGF-I e IGF-II), péptidos producidos principalmente en el hígado (y también en otros órganos: branquias, cartílago, etc.) que median las acciones de la GH (McCormick y col., 1991; Madsen y col., 1995; McCormick, 1996). El papel de la GH en los procesos osmorreguladores varía dependiendo de la especie estudiada, e incluso de la salinidad a la cual está adaptada esa especie (Sakamoto y col., 1993; McCormick, 1995, 2001; Mancera y McCormick, 1998 a, b, 2007). La temperatura también muestra un importante papel en el control de la actividad del sistema GH/IGF, apreciándose una activación de dicho sistema (mayores niveles de expresión de GH adenohipofisaria, incremento en los niveles plasmáticos, etc.) al aumentar la temperatura ambiental (S. salar: McCormick y col., 2002; Ciprinus carpio: Figueroa y col., 2005; Perca flavescens: Lynn y col., 2008). Esta activación del sistema GH/IGF en teleósteos se ha relacionado con la estimulación que sufre el metabolismo basal de los animales poiquilotermos sometidos a un incremento de temperatura y que origina un mayor crecimiento en los meses más cálidos del año (Pérez-Sánchez y col., 1994; Pérez-Sánchez y Le Bail, 1999). A nivel de esmoltificación, la GH e IGF-1 se incrementan en la sangre durante este proceso, lo cual produce una sinergia con la NKA y el cortisol, lo que hace que los peces estén preparándose para comenzar la migración al mar (McCormick y col., 2007). Esta hormona parece ser la primera que se incrementa con la manipulación del fotoperiodo, siendo una pieza clave en este proceso (McCormick, 2013).
Cortisol El eje hipotálamo-hipofisario-interrenal (HHI), responsable de la respuesta al estrés en teleósteos, consta de determinados núcleos hipotalámicos que sintetizan y liberan la CRF (Factor de liberación de la Corticotropina “Corticotropin releasing factor”). Este factor hipotalámico activa las células adrenocorticotropas adenohipofisarias para liberar la ACTH (hormona adenocorticotropina) al torrente sanguíneo. Esta hormona alcanza la glándula interrenal y estimula la liberación de cortisol a la sangre. En la respuesta al estrés se diferencian: i) respuesta primaria, caracterizada por la liberación de catecolaminas y cortisol a sangre; ii) respuesta secundaria con cambios a nivel plasmático y tisulares relacionados con ajustes de diversos procesos fisiológicos; y iii) respuestas terciarias, donde los cambios se aprecian a nivel de individuos (crecimiento, comportamiento, reproducción, etc.) (Wandelaar Bonga, 1997; Barton, 2002). El cortisol, considerado como el producto final del eje HHI, puede actuar en teleósteos como mineralcorticoide y glucocorticoide. Su actividad como mineralocorticoide es la responsable de la aclimatación a los cambios de salinidad. En cambio, la actividad como glucocorticoide es la responsable del incremento de los niveles plasmáticos de glucosa, lactato y otros metabolitos que sirven de fuente energética para los diferentes órganos del animal. En la mayoría de los estudios, el cortisol es la hormona que se utiliza para cuantificar los niveles de estrés en situaciones experimentales (Barton y Peter, 1982; Wendelaar Bonga, 1997; Mommsen y col., 1999; Barton, 2002; Donaldson, 2008; McCormick 2013). De este modo, son variados los factores que inducen una activación del sistema de estrés en los teleósteos: captura, alta densidad, manipulación, ejercicio intenso, incorporación de tóxicos, cambios en la salinidad, pH, temperatura, e incluso la esmoltificación. Se ha observado una relación entre la GH y el cortisol, aumentando desde estadios parr a smolt. Además hay una sinergia entre GH-Cortisol-NKA, lo que nos indica que este incremento del cortisol está influenciando de manera directa por la migración de los peces al mar (McCorcmick, 2001).
Hormonas Tiroideas La hormona estimulante del tiroides (TSH) es sintetizada por las células tirotropas de la hipófisis y vía torrente sanguíneo, alcanza los folículos tiroideos donde estimula la síntesis y liberación de las dos hormonas tiroideas: la tiroxina (T4) y la 3, 5, 3-triyodotironina (T3 ) (Arjona y col., 2008), según el siguiente esquema de síntesis: a) Tiroglobulina » Monoyodotirosina (MIT) » Diyodotirosina (DIT)
b) Dos moléculas de diyodotirosina se unen formando la tetrayodotironina o tiroxina (T4): DIT + DIT » T4
c) Una molécula de monoyodotirosina se une con una molécula de diyodotirosina formando la triyodotirosina o T3: MIT + DIT » T3
La función de las hormonas tiroideas se ha modificado a lo largo de la línea evolutiva, pero muy resumidamente podemos ver que presentan acciones: i) morfológicas y madurativas (crecimiento y diferenciación), y ii) metabólicas (metabolismo de carbohidratos, lípidos, nitrógeno, etc.) (Tabla 1). Las hormonas tiroideas regulan diversos procesos fisiológicos, pero el papel osmorregulador en teleósteos no está muy claro (Grau, 1987; McCormick, 1995). En salmónidos el sistema tiroideo es importante durante el proceso de esmoltificación, que le permite al animal migrar hacia el agua de mar. Así, repetidas inyecciones con T4 incrementan la actividad Na+,K+-ATPásica y el número de células de cloruro en Salmo salar (Madsen y Korsgaard, 1989) y Oncorhynchus mykiss (Madsen, 1990), pero no en otras especies (ver McCormick, 1995). Además, una interacción entre T3 y GH o cortisol ha sido mostrada en Salmo trutta y O. mykiss aclimatados en agua de mar sugiriendo la existencia de una sinergia entre estas hormonas. (Leloup y Lebel, 1993; Shrimpton y McCormick, 1998). Esta interacción, ha sido relacionada con la capacidad de la hormona T3 para aumentar el número de receptores de cortisol en las branquias (Shrimpton y McCormick, 1998).
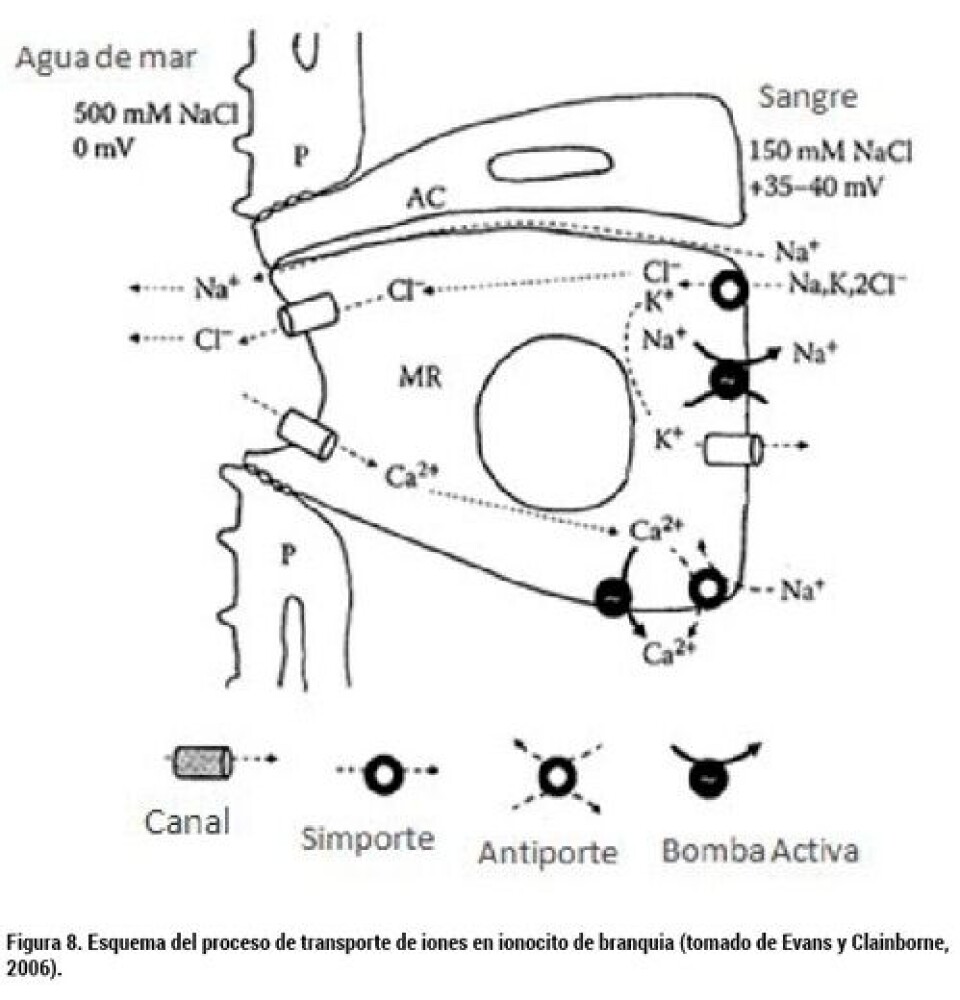
3. Osmorregulación El proceso de osmorregulación está estrechamente ligado a que todos los peces son capaces de mantener una concentración de solutos independiente de lo que presenta el ambiente (Edwards y Marshall, 2013). Los procesos de osmorregulación en salmónidos son muy importantes, ya que de éstos depende la sobrevida en el nuevo ambiente hiper-osmótico (agua de mar). Adicionalmente, se deben tener en consideración aspectos como la pérdida de agua a través de las branquias; y el consumo de agua en ambiente marino para la mantención del balance osmótico y consecuente aumento de la osmolalidad sanguínea, la cual es regulada por la secreción de NaCl. La industria acuícola tiene en consideración este aspecto por medio de la medición de la Na+,K+-ATPasa, ya que esta bomba sufre un cambio a nivel de actividad, lo cual hoy es considerado como un examen de rutina para determinar si los smolts están listos para ser trasladados al mar. La osmorregulación es sobrellevada por órganos osmorreguladores capaces de poder mantener la homeostasis, tales como las branquias a través de un transporte activo de iones, y el tracto gastrointestinal, el cual aumenta la osmolaridad en el pez (Parry, 1966; Conte, 1969), así como también el riñón, el cual es capaz de reducir el flujo de orina (es decir, concentrar la orina). Las branquias, específicamente, poseen dos tipos celulares: las células pavimentosas y otro tipo de células llamadas ionocitos o células de cloruro, también conocidas como células de “Keys- Willmer”, ya que en 1932 fueron descritas por Keys y Willmer. Las células epiteliales participan principalmente en el intercambio gaseoso, excreción de residuos nitrogenados, equilibrio ácido base y osmorregulación, principalmente, en ambientes hipo-osmóticos, ayudando a la captación de Cl-. Mientras tanto, los ionocitos se establecen claramente relacionados con la excreción/captación de iones como Na+ y Cl- y también en la captación de Ca2+. Todos estos procesos finalmente se pueden mencionar en resumir muy simples como la capacidad del pez para mantener una cantidad apropiada de agua y una concentración apropiada de solutos en sus fluidos corporales. La adaptación fisiológica al ambiente hiper-osmótico es un proceso gradual, que implica, entre otros aspectos, la destrucción y síntesis de componentes moleculares de los sistemas de transporte, así como también cambios en la morfología y número de ionocitos. Específicamente los cambios se pueden resumir en los siguientes: incremento en la expresión génica, con un consecuente aumento en la cantidad y actividad de la bomba Na+, K+-ATPasa (NKA), la cual se ha establecido que posee sensibilidad tanto a la temperatura ambiental como también con el fotoperíodo (Zaugg y col., 1972; Adams y col., 1973; Clarke y col., 1978), y aumento en la expresión del co-transportador Na+/ K+/Cl- (NKCC), permitiendo así una mantención adecuada de agua y de solutos en el medio interno, independiente de la presión osmótica del medio externo. Básicamente, el funcionamiento de las células de cloruro en ambientes hiper-osmóticos para la mantención de la homeostasis en teleósteos se puede dividir en tres componentes. El primero, referido a la NKA, considerado como la fuerza conductora primaria, permite mantener bajas concentraciones de Na+ intracelular sacando este ión e ingresando K+. El segundo, corresponde al co-transportador Na+/K+/Cl- del tipo NKCC, el cual acumula Cl- intracelular y también ingresa K+ a la célula. Luego, el tercero, estrechamente ligado al segundo, corresponde a canales específicos del tipo CFTR (del inglés Cystic fibrosis transmembrane conductance regulator), el cual permite el abandono pasivamente del Cl-. El Cl-, a su vez, establece una gradiente de potencial, la cual permite al Na+ atravesar el epitelio pasivamente por vía para-celular (Figura 8).
4. Variables ambientales: fotoperiodo y temperatura Estos son dos de los factores ambientales más importantes, siendo el fotoperiodo el que tiene una gran ingerencia en la esmoltificación (Hoar, 1988). Se ha establecido que el incremento en las horas de luz o el alargamiento del día se requiere para que la esmoltificación siga con su ritmo normal, aunque se ha visto que bajas temperaturas pueden afectar este proceso en algunas especies (Fry, 1971; McCormick y col., 2000). Un buen ejemplo de esta relación luz-fisiología es que la GH es sensible a los cambios en el fotoperiodo, es decir se incrementa la cantidad de GH en la sangre con más horas luz y disminuye al tener menos luz, McCormick y colaboradores (1995) demostró esta relación que además trae como sinergia que la NKA en branquias posea esta misma relación. Respecto de la temperatura en ambiente natural, está fuertemente unida a los tiempos de migración. Los rangos en que se produce dicha migración van desde los 5,8 °C a los 15 °C según lo que exponen diversos autores (Wedemeyer y col., 1980; McCormick y col., 1998; Heinimaa, 2003; Holm y col., 2003). Es muy conocido en la industria salmonicultora que el factor más importante para alterar la esmoltificación es el fotoperiodo, pero no debemos olvidar que la temperatura juega un rol importante, unido a este fotoperiodo.
5. Migración de otras especies de salmónidos Dentro de los salmónidos hay variaciones en los tiempos de esmoltificación, por ejemplo Oncorhynchus gorbuscha y O. keta (salmón rosa “pink” y salmón chum) comienzan su migración a las pocas semanas después de la eclosión, a diferencia de otras especies como el Salmo salar (salmón Altlántico), O. kisutch (salmón coho), O. mykiss (trucha arcoíris-cabeza de acero “steelhead”), que pueden pasar al menos un año en agua dulce antes de migrar, lo que nos indica que dependiendo de la especie que queramos cultivar los tiempos de migración son muy importantes (McCormick, 2013)
Agradecimientos Los autores agradecen al Proyecto Innova Corfo 13IDL2-23565, al Fondap-Incar, No. 15110027 y al Fondecyt 11130308 y a las empresas Marine Harvest Chile y Asesorías e Inversiones Trapananda LTDA.
Para revisar la literatura citada puede descargarla desde https://www.salmonexpert.cl/?page_id=221

















