ISAv y HPR0: Origen y Destino
Sergio H. Marshall Ph.D. (Harvard/81) Director Laboratorio de Patógenos Acuícolas – Referencia OIE para el virus ISA - Núcleo Biotecnología Curauma – Pontificia Universidad Católica de Valparaíso – Campus Curauma. Valparaíso.
Introducción Es muy probable que la captura de peces silvestres desde el mar disminuya con el tiempo en favor de la producción de peces en cultivo confinado, para poder satisfacer los crecientes requerimientos de fuentes de proteínas para el consumo humano. En la actualidad, ya hay una proporción creciente de variados productos del mar que provienen de la acuicultura y, para el caso de peces, el salmón Atlántico lleva una promisoria delantera. Esto, claramente, sugiere que es hora de preocuparnos seriamente de la necesidad de criar peces de forma sostenible. A pesar de que el desarrollo de la salmonicultura en jaulas ha sido exitoso, también plantea peligros para la salud humana y la economía ambiental, amenazas reconocidas en todas las latitudes donde ésta se practica y donde las enfermedades infecciosas encuentran un nicho ideal para evolucionar rápidamente en infecciones agudas y transmisibles (1 - 3). Como es sabido, en Chile, el desarrollo de la salmonicultura se inició a principios del siglo XX, al introducirse la producción de una especie de trucha en el sur del país, pero no fue hasta los inicios de los años ochenta que comenzó a masificarse con la introducción y cría de ciertas especies de peces, convirtiéndose en uno de los principales motores del sostenido y exitoso crecimiento exportador de los últimos 20 años, concentrando un 31% de la producción mundial de salmón cultivado (4). A pesar de que las enfermedades infecciosas de origen bacteriano, virales, parasitarias y fúngicas, así como otras patologías no-infecciosas asociadas con las tecnologías de cultivo siempre la han amenazado (BKD, en 1987; SRS, en 1989; IPN, en 1997; y la Caligidosis, en 2007), no fue hasta el 25 de julio del 2007 cuando la industria salmonicultora chilena sintió su fragilidad absoluta. Ese día se oficializó la detección de la presencia del virus ISA (siglas en inglés de la Anemia Infecciosa del Salmón) en un ejemplar de salmón Atlántico (Salmo salar) en la isla Lemuy, Chiloé. Este virus comenzó a propagarse primero en la Región de Los Lagos y luego en las regiones de Aysén y Magallanes, llevando a la salmonicultura a su peor crisis sanitaria desde sus inicios.
Anemia Infecciosa del Salmón (ISA) y su agente etiológico (ISAv) La Anemia Infecciosa del Salmón, en adelante ISA, es una enfermedad altamente contagiosa que ataca preferentemente al salmón Atlántico, que es la principal especie cultivada en Chile. En los peces afectados, provoca anemia severa y hemorragias en varios órganos, específicamente en hígado, riñón, intestino y branquias. Salmones infectados con ISA pueden transmitir la enfermedad varias semanas antes de mostrar signos clínicos de la infección (5). Se detectó por primera vez en Noruega en 1984 y posteriormente hubo reportes en la provincia canadiense de New Brunswick en 1996, Nova Scotia en 2000, Reino Unido - Escocia en 1998 y, más tarde, en las islas Shetland- Islas Faroe también en 2000 y Estados Unidos - Maine en 2001. (6,7). Su agente etiológico es un virus de RNA perteneciente a la familia Ortomyxoviridae, y se le conoce como” virus de la anemia infecciosa del salmón”, en adelante ISAv (8 – 10).
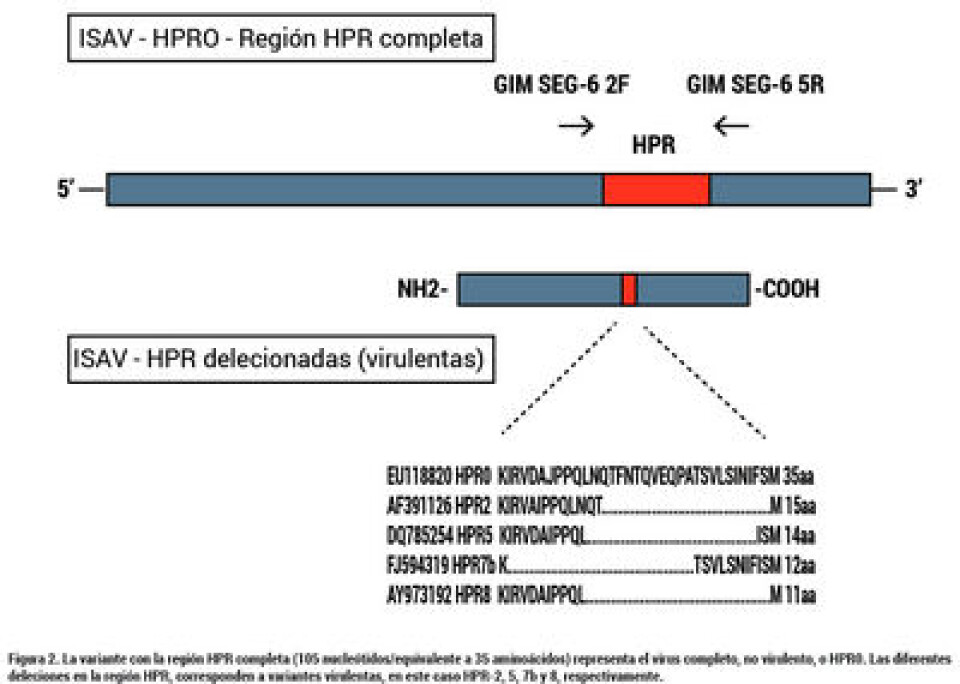
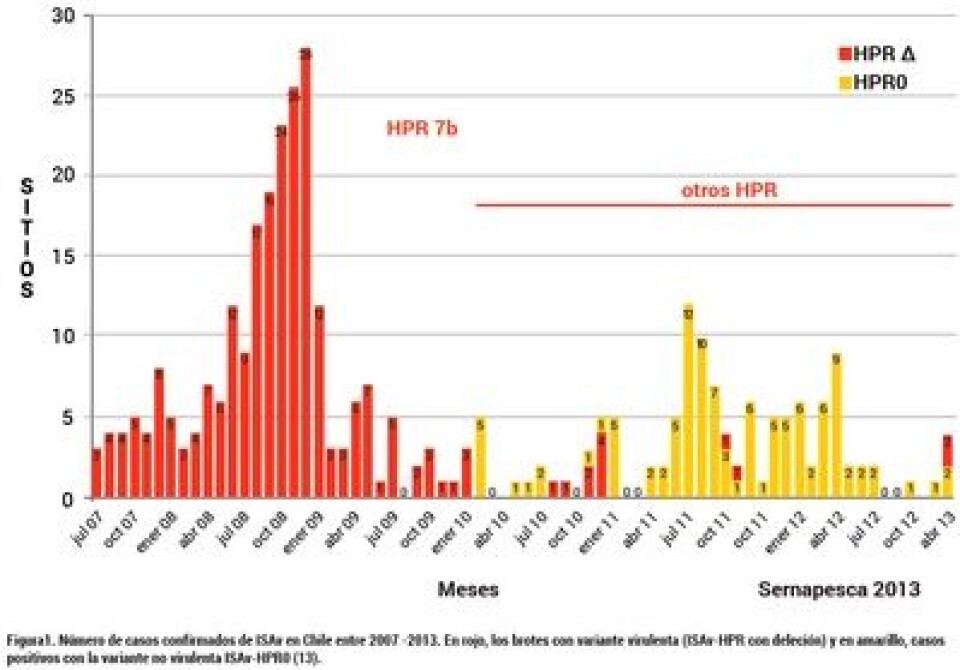
La aparición de la variante HPR0 (ISAv-HPR0). En Chile, al igual que en otras latitudes, luego de la crisis sanitaria del año 2007, los brotes de la enfermedad fueron disminuyendo paulatina y considerablemente en el tiempo, registrándose el último brote en diciembre del año 2010. Desde esa fecha hasta la actualidad, no se ha detectado mortalidad significativa por ISAv en los centros de cultivo del país, sin embargo, la variante ISAv mayormente diagnosticada, principalmente en las regiones de Los Lagos y Aysén, ha sido ISAv-HPR0, como lo muestra la Figura 1. Esta variante, definida como de baja virulencia, es prevalente también en salmón Atlántico noruego, así como es la misma especie cultivada en las Islas Faroes, donde está asociada con una infección subclínica, transitoria y también altamente prevalente (11). La principal diferencia entre las cepas virulentas y las no virulentas es que las primeras presentan una deleción, distinta entre ellas, de una región de alta variabilidad polimórfica en el segmento genómico 6 del virus, que por ello se ha denominado región HPR, y que por estar completa en la variante no virulenta constituye el virus ancestral o ISAv-HPR0 y sus variantes delecionadas, las HPR con un numeral que representan diferente grado de patogenicidad. Esto se resume en la Figura 2. Existen abundantes estudios de análisis filogeográficos y de distribución ambiental de ISAv-HPR0 así como de asociaciones entre ISAv virulento e ISAv-HPR0 con el objetivo de evaluar la hipótesis de que ISA HPR0 sea el “virus madre” y como tal, precursor de las variantes ISAv virulentas (12 – 15). En resumen de estos trabajos, se detecta la presencia de ISA HPR0 en grupos de peces cultivados en agua dulce y mar, incluyendo juveniles y reproductores y los resultados obtenidos sugieren que la población de ISAv HPR0 está geográficamente estructurada. La asociación espacial entre grupos de peces con ISAv virulento y de baja virulencia apoya la hipótesis de que ISAv-HPR0 puede evolucionar a ISAv virulento, sugiriendo que existe un riesgo asociado a la infección con dicha variante.
Nuestro estudio La Figura 1 claramente indica que una vez expresada una cepa virulenta, muy luego aparece la variante HPR0. Como esta última no involucra deleción de la región HPR del segmento genómico 6, es muy probable que de ella se deriven por mutación en dicha región blanco, las cepas virulentas (HPR-delecionada), principalmente resultantes de las condiciones de estrés que conlleva el cultivo confinado. Sin embargo, eso también sugiere que la variante ISAv-HPR0 es la que regula el equilibrio entre cepas virulentas (delecionadas en la región HPR) y ella misma, como la variante no virulenta pero que asegura la subsistencia del virus como entidad potencialmente infectiva y destructora. De ser así, la presencia de esta cepa representa un riesgo de reemergencia de los casos virulentos de ISAv. Para comprobar esta posibilidad, evaluamos la persistencia y potencial de mutación hacia formas delecionadas, de una variante pura y caracterizada por secuenciación como ISAv-HPR0 en dos líneas celulares establecidas. Dicha cepa fue aislada de branquias de peces asintomáticos, con una alta tasa de replicación sistémica como lo reflejaban los bajos valores de Ct por PCR en tiempo real cercanos a 18, lo que es indicativo de una alta carga viral. El virus fue purificado por ultra-centrifugación en gradientes de equilibrio para realizar la infección inicial en las líneas celulares, seguido de pasajes ciegos cada 15 días, y evaluado por Microscopía Electrónica.
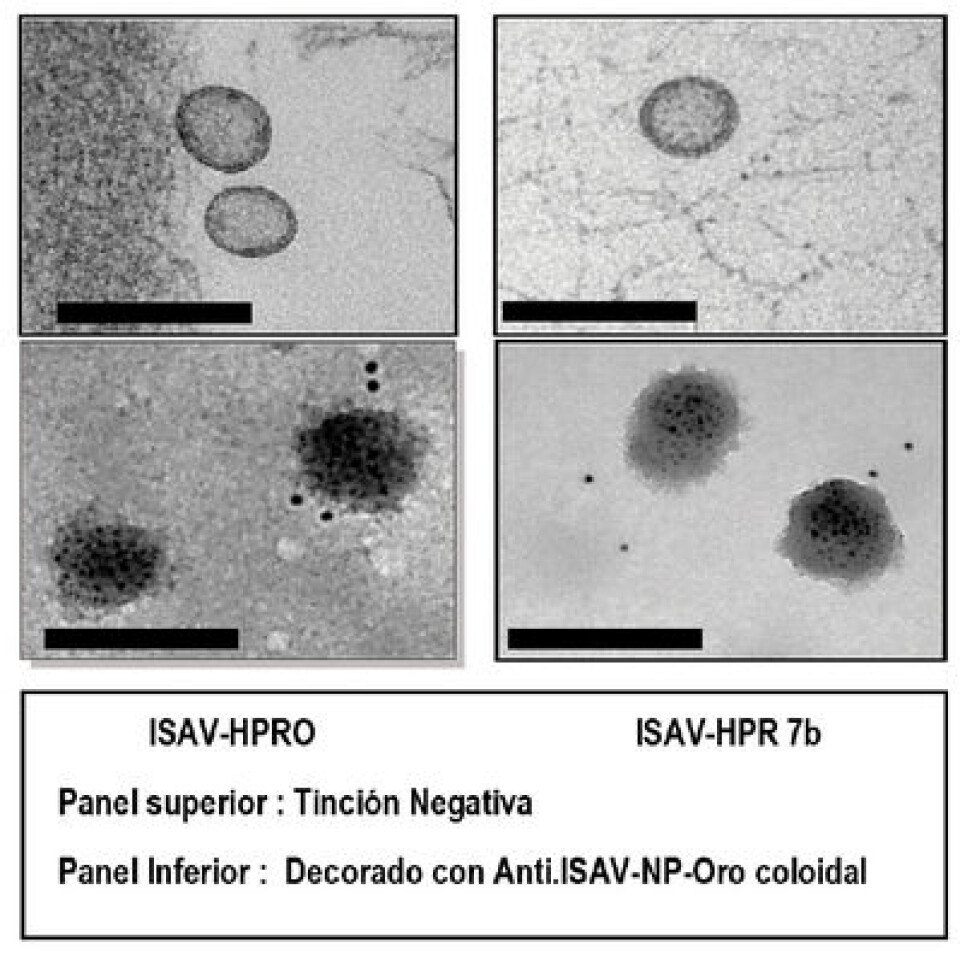
Resultados 1.- Al día 31, a pesar de que nuestros cultivos no demostraban efecto citopático alguno, alícuotas del sobrenadante fueron concentrados en una microfuga y cargados en gradillas ad hoc para ser analizados por microscopía electrónica por tinción negativa. La Figura 3-A demuestra que hay virus, similar al equivalente de la variante infectiva causante de la epizootia del año 2007 (ISAv-HPR 7b). La Figura 3b, confirma que las estructuras observadas corresponden a ISAv, al responder positivamente a la decoración con un anticuerpo monoclonal para la proteína de la nucleocápsida viral. 2.- Al día 31, con el mismo virus, definido adicionalmente por secuenciación como ISAv-HPR0, se re-infectaron varias botellas con células limpias, y al día 251 después de sucesivos pasajes sin un efecto citopático evidente, se recuperaron los sobrenadantes, purificando de ellos eventuales virus, los que fueron comprobados por secuenciación, y encontramos que, persistiendo la variante madre ISAv-HPR0, también aparecieron variantes delecionadas, confirmado nuestra hipótesis de que, por presión de selección y en el tiempo, ISAv-HPR0 genera formas delecionadas en la región HPR del segmento genómico 6. Los resultados de la secuenciación se presentan en la Tabla 1.
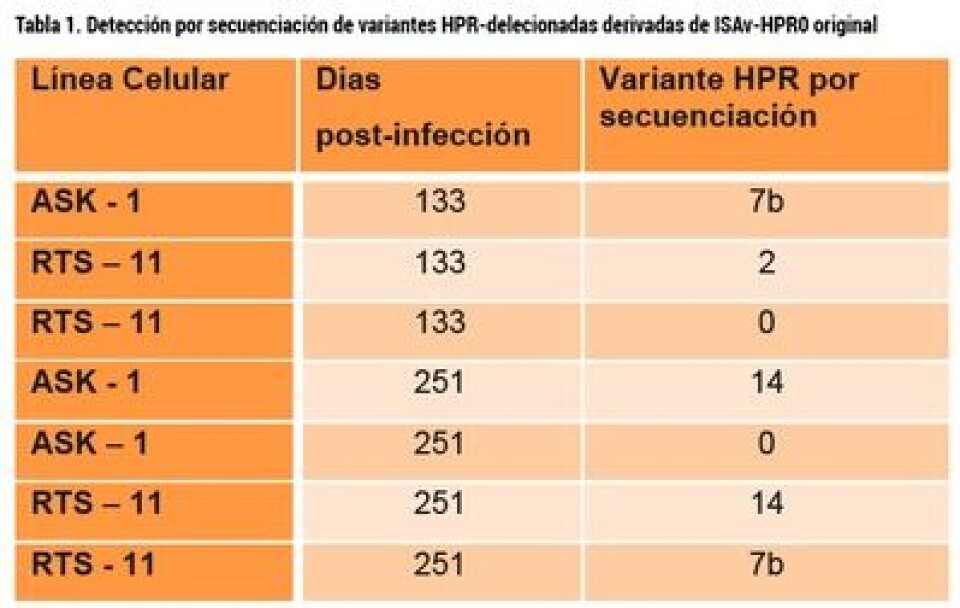
Conclusiones. • ISAv-HPR0 infecta en forma persistente cultivos celulares, situación que es extrapolable al sistema in vivo. • ISAv-HPR0 es estructuralmente idéntico a la variante infectiva ISAv-HPR 7b • Tiempos prolongados de cultivo de ISAv-HPR0 en líneas celulares, inducen deleciones en la región HPR, demostrando que dicho proceso puede ser el gatillante para romper el equilibrio entre variantes no infectivas a infectivas. • La co-existencia de variantes sería un mecanismo de autoregulación del virus, donde ISAv-HPR0 juega un rol fundamental
Lógica de las Conclusiones: • Se ha demostrado que el virus puede permanecer en las jaulas por seis meses sin presentar mortalidades y, luego de este tiempo, expresarse con tasas de mortalidad de hasta un 90%. (epizootia año 2007-2009). • HPR0 fue detectado en Chile por vez primera en 2008 y pasó a ser endémico de Chile, y en co-existencia con las cepas virulentas registradas en los brotes de 2013 (16). • Esto sugiere que los brotes leves del último año no se deben a introducciones recientes del virus a Chile, sino al desequilibrio dirigido por el virus ancestral (ISAv-HPR0) hacia formas virulentas (ISAv- HPR-delecionadas). • Las infecciones por ISAv-HPR0 son temporales con altos y bajos en la prevalencia, lo que nuevamente refuerza el esquema de equilibrios entre las formas avirulentas y virulentas. • La transición de avirulencia a virulencia parece ser un proceso gradual a partir del virus madre; la persistencia puede ser una estrategia de supervivencia del virus y ya hay tecnologías alternativas de evaluación que nos permiten verificarlo (17,19). • Las infecciones mixtas necesitan ser más estudiadas, y como ya hemos logrado que el ISAv-HPR0 crezca en cultivo celular, podemos realizar nuevas infecciones.
Agradecimientos: A los Drs. Constanza Cárdenas, Marisela Carmona y a los Srs Alvaro Labra, Ramón Ramírez y Cristian Muñoz, miembros activos de mi laboratorio quienes han contribuido con su trabajo a este tema.
Bibliografía. 1.- R.L. NAYLOR, R.J. GOLDBURG, J.H. PRIMAVERA, N. KAUTSKY, M.C.M. BEVERIDGE, J. CLAY, C. FOLKE, J. LUBCHENCO, H. MOONEY AND M. TROELL. (2000). Effect of aquaculture on world fish supplies. Review. Nature 405, 1017-1024 2.- A.G. MURRAY AND E.J. PEELER. 2005. A framework for understanding the potential for emerging diseases in aquaculture. Preventive Veterinary Medicine, 67 (2–3): 223–235. 3.- STENTIFORD GD, NEIL DM, PEELER EJ, SHIELDS JD, SMALL HJ, FLEGEL TW, VLAK JM, JONES B, MORADO F, MOSS S, LOTZ J, BARTHOLOMAY L, BEHRINGER DC, HAUTON C, LIGHTNER DV. 2012. Disease will limit future food supply from the global crustacean fishery and aquaculture sectors. J. Invertebr. Pathol.;110(2):141-157. 4.- FUNDACION CHILE. Salmonicultura. Agosto 2012. 5.- MIKALSEN A.B., TEIG A., HELLEMAN A.-L., MJAALAND S. & RIMSTAD E. (2001). Detection of infectious salmon anaemia virus (ISAv) by RT-PCR after cohabitant exposure in Atlantic salmon. Dis. Aquat. Org., 47, 175–181. 6.- F. S. B. KIBENGE, K. MUNIR, M. J. T. KIBENGE, T. JOSEPH AND E.MONEKE. 2004. Infectious salmon anemia virus: causative agent, pathogenesis and immunity. Animal Health Research Reviews, 5 (1): 65-78. 7.- WORLD ORGANISATION FOR ANIMAL HEALTH (OIE), Capitulo 2.1.9. Anemia Infecciosa del Salmón. 8.- FALK K., NAMORK E., RIMSTAD E., MJAALAND S. & DANNEVIG B.H. (1997). Characterization of infectious salmon anemia virus, an orthomyxo-like virus isolated from Atlantic salmon (Salmo salarL). J. Virol., 71, 9016–9023. 9.- KROSSOY B., HORDVIK I., NILSEN F., NYLUND A. & ENDRESEN C. (1999). The putative polymerase sequence of infectious salmon anemia virus suggests a new genus within the Orthomyxoviridae. J.Virol., 73, 2136–2142. 10.- MJAALAND S., RIMSTAD E., FALK K. & DANNEVIG B.H. (1997). Genomic characterisation of the virus causing infectious salmon anemia in Atlantic salmon (Salmo salar L): an orthomyxo-like virus in a teleost. J. Virol., 71, 7681–7686. 11.- D. H. CHRISTIANSEN, P. S. ØSTERGAARD, M. SNOW, O. B. DALE AND K. FALK. 2011. A low-pathogenic variant of infectious salmon anemia virus (ISAv-HPR0) is highly prevalent and causes a non-clinical transient infection in farmed Atlantic salmon (Salmo salar L.) in the Faroe Islands. Journal of General Virology, 92: 909–918. 12.-. DEVOLD M., FALK K., DALE B., KROSSOY B., BIERING E., ASPEHAUG V., NILSEN F. & NYLUND A. 2001. Strain variation, based on the hemagglutinin gene, in Norwegian ISA virus isolates collected from 1987 to 2001: indications of recombination. Dis. Aquat. Org., 47, 119–128. 13.- M.G. GODOY, M. J.T. KIBENGE, R. SUAREZ, E. LAZO, A. HEISINGER, J. AGUINAGA, D. BRAVO, J. MENDOZA, K. O. LLEGUES, R. AVENDAÑO-HERRERA, C. VERA, F. MARDONES AND F.S.B. KIBENGE. 2013. Infectious salmon anaemia virus (ISAv) in Chilean Atlantic salmon (Salmo salar) aquaculture: emergence of low pathogenic ISAv-HPR0 and re-emergence of virulent ISAv-HPRΔ: HPR3 and HPR14. Virology Journal,10:344. 14.- LYNGSTAD TM., KRISTOFFERSEN AB., HJORTAAS MJ., DEVOLD D., ASPEHAUG V., LARSSEN RB.,JANSEN PA.2012. Low virulent infectious salmon anaemia virus (ISAv-HPR0) is prevalent and geographically structured in Norwegian salmon farming. Diseases of Aquatic Organisms 101: 197–206. 15.- MCBEATH A .JA., HO Y.M., AAMELFOT M., HALL M., CHRISTIANSEN D., MARKUSSEN T., FALK K., MATEJUSOVA I. 2014.Low virulent infectious salmon anaemia virus (ISAv) replicates and initiates the immune response earlier than a highly virulent virus in Atlantic salmon gills. Veterinary Research 45: 83. 16.-CÁRDENAS C, CARMONA M, GALLARDO A, LABRA A, MARSHALL S.H. (2014). Coexistence in field samples of two variants of the infectious salmon anemia virus: a putative shift to pathogenicity. PLoS One. 2014 Jan 30;9(1):e87832. doi: 10.1371/journal.pone.0087832. 17.- SEPÚLVEDA D, CÁRDENAS C, CARMONA M, MARSHALL S.H. (2012) “Novel strategy to evaluate Infectious Salmon Anemia Virus variants by High Resolution Melting”. PLoS ONE 7(6): e37265. doi:10.1371/journal.pone.0037265. 18.- CARMONA M, SEPÚLVEDA D, CÁRDENAS C, NILO L, MARSHALL S.H. (2012) “Denaturing Gradient Gel Electrophoresis (DGGE) as a powerful novel alternative for differentiation of epizootic ISA virus variants”. PLoS ONE. 7(5) e37353. doi:10.1371/journal.pone.0037353. 19.- MARSHALL S.H, RAMÍREZ R, LABRA A, CARMONA M, MUÑOZ C. (2014) Bona Fide Evidence for Natural Vertical Transmission of Infectious Salmon Anemia Virus in Freshwater Brood Stocks of Farmed Atlantic Salmon (Salmo salar) in Southern Chile. J Virol. 88(11):6012-8. doi: 10.1128/JVI.03670-13.




















