Producción de juveniles de salmónidos
Aprendiendo Acuicultura está compuesta por una serie de artículos destinada a quienes tienen una participación activa en la industria acuícola. Esta sección está organizada con el propósito de entregarle información que esperamos encuentre útil en su trabajo diario, pues cuanto más conocimiento tenga, mejor podrá optimizar las condiciones de los peces y, un mejor bienestar animal, conduce a un desempeño más productivo y sustentable. Quisiéramos recibir sus observaciones y comentarios acerca de esta serie y apreciaremos sus sugerencias para futuros temas que le gustaría ver abordados aquí. Por favor envíenos sus comentarios a contacto@salmonexpert.cl
Ph.D. Gustavo Parada Rebolledo Gerente general en APTA-AQ g.parada.r@apta-aqua.com
Ovas e incubación El agua dulce es el recurso natural esencial para la producción de smolt de salmónidos y es el medio en el cual se inicia la producción industrial de estos peces y se realiza la reproducción. El cultivo industrial de salmones se ha desarrollado en torno al ciclo de vida, la cual no es otra cosa que la expresión del programa genético de la especie, resultado de millones de años de adaptación al ambiente a través de selección natural. Este artículo pretende entregar algunas nociones sobre el estado de las prácticas de crianza de peces en su fase de agua dulce. No pretende cubrir todos los aspectos que se requieren manejar para establecer una producción óptima a la necesidad específica de un plan de engorda, lo cual es necesario al establecer planes de producción que aseguren fechas de entrega y tamaño de los smolts producidos, ni tampoco detalla los múltiples manejos intermedios necesarios durante la producción en agua dulce. Lo que veremos es cómo dar condiciones ambientales apropiadas para el buen desempeño del cultivo.

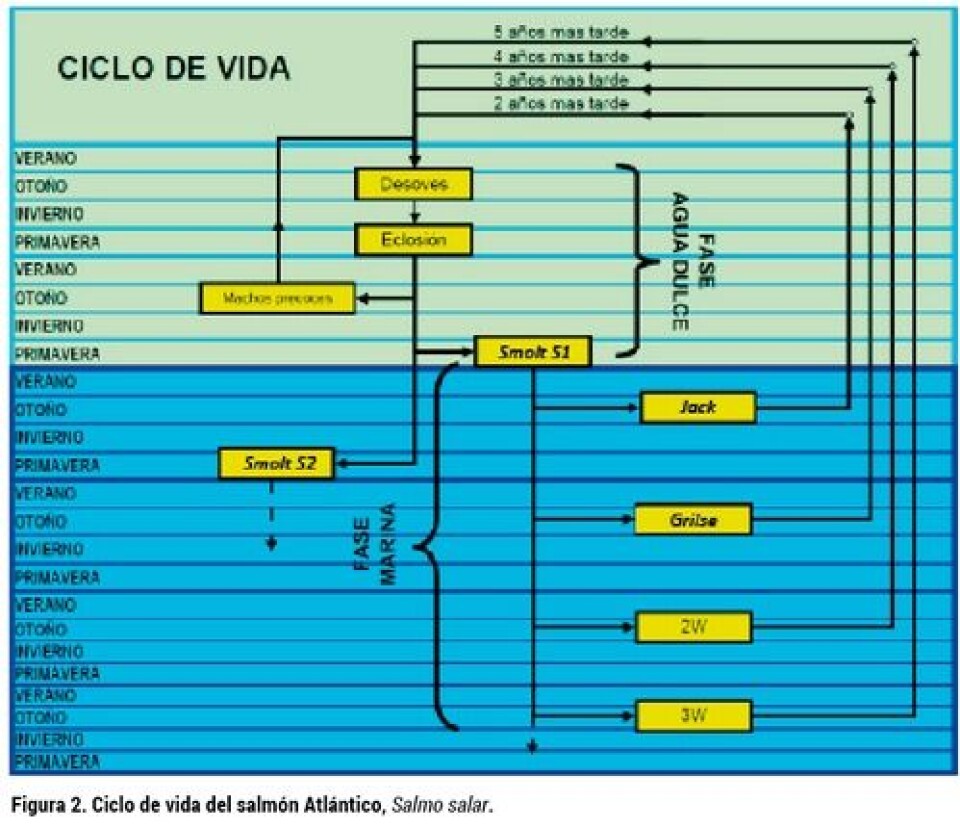
Breve descripción del ciclo de vida del salmón Atlántico Una nueva generación de salmones nace durante la temporada de desove que ocurre en agua dulce , en el mismo lugar donde sus padres nacieron, y que han vuelto después de una larga travesía en el mar que demoró entre 1,5 y 6 o quizás más años. El desove del salmón Atlántico (Salmo salar) se produce en el otoño del hemisferio norte, lo que equivaldría en nuestro hemisferio (sur) a los meses de abril a junio, dependiendo de la cepa. Las ovas fecundadas se desarrollan hasta eclosionar después de un periodo de incubación que es mas largo mientras más bajas sean las temperaturas que se experimenten. Después del periodo de incubación, la eclosión libera un alevín que aún conserva parte del saco vitelino, y el nuevo salmón sigue su desarrollo sin ingesta de alimento, escondido en la grava donde las ovas fueron depositadas. Recién al término de la absorción del vitelo, los nuevos peces inician gradualmente su salida desde su lugar seguro, para aventurarse en la columna de agua en búsqueda de alimento. En este momento los alevines sólo pesan entre 100 y menos de 200 mg. En condiciones naturales, los alevines inician su alimentación desarrollándose hasta el estado parr de 5 a 8 cm, que muestra típicas marcas laterales (figura 1A), para posteriormente transformarse en un pez adaptado para vida marina denominado smolt (figura 1B) y migra al mar. El smolt va al mar, donde crece hasta la madurez sexual, que se inicia en el invierno, para migrar en el siguiente otoño a desovar en agua dulce y reproducirse. El salmón que se reproduce después del primer invierno en el mar se denomina grilse, después del segundo invierno se denomina salmón o simplemente reproductor de dos inviernos o reproductor 2W, los peces que maduran más tarde se denominan reproductor 3W, 4W, etc., según el número de inviernos en el mar antes de madurar. Ver figura 2. La proporción de los smolts que se transforman en reproductores de uno, dos, o más inviernos depende de la genética de la cepa, que con seguridad está moldeada a las condiciones del río donde desovan, para proporcionar ventajas en la mantención de la especie. Así, hay cepas nativas de madurez temprana (alto proporción de grilse) y de madurez tardía (baja proporción de grilse). En adición a los individuos que maduran después de pasar un invierno o más en el mar, existen los denominados machos precoces y los jacks. Los primeros, son peces que maduran tempranamente desde el estado parr sin salir nunca del agua dulce, y los segundos son smolts que salen al mar en primavera y terminan su maduración inmediatamente en el siguiente otoño (ver figura 2), ambos son sólo individuos machos. El papel biológico de estos peces sería la fertilización de ovas cuando hay carencia de machos maduros de un invierno o más. La gran adaptación del salmón al lugar donde se reproduce y realiza la etapa de agua dulce de su ciclo de vida, asegura la supervivencia de la raza. Sin embargo, esta perfecta adaptación para la vida silvestre en el lugar geográfico específico, no coincide necesariamente con las características deseables para una producción intensiva en cautiverio. Estos peces, en su hábitat natural, viven en abundancia de agua y bajo restricciones de alimento, por lo que la alteración de la calidad del agua en que viven es baja o despreciable. En cambio, en la producción intensiva de salmones en cautiverio, la densidad de cultivo (peces o kg por metro cúbico de agua) alcanza varios cientos de veces las que ocurren en la naturaleza, y el alimento se proporciona en abundancia. Por esta razón, la mantención de calidades de agua compatibles con la especie es uno de los desafíos tecnológicos para los diseñadores de los sistemas de cultivo, como lo son también la adaptación de la especie silvestre a un animal de crianza y el desarrollo de los alimentos óptimos para la especie.
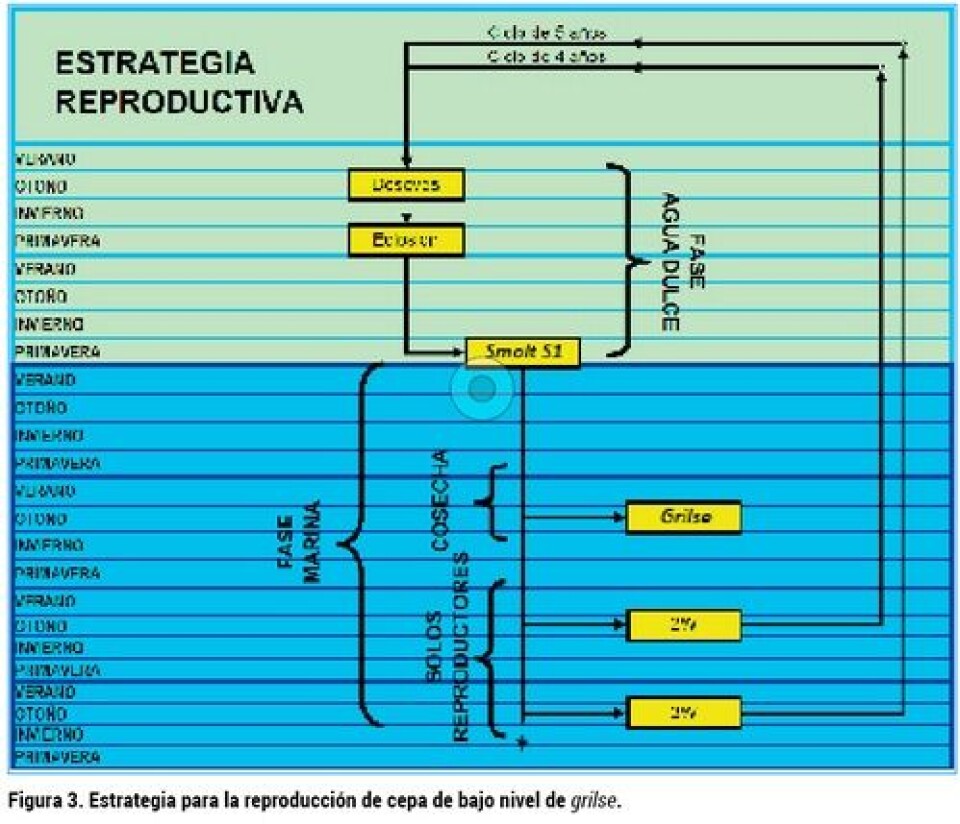

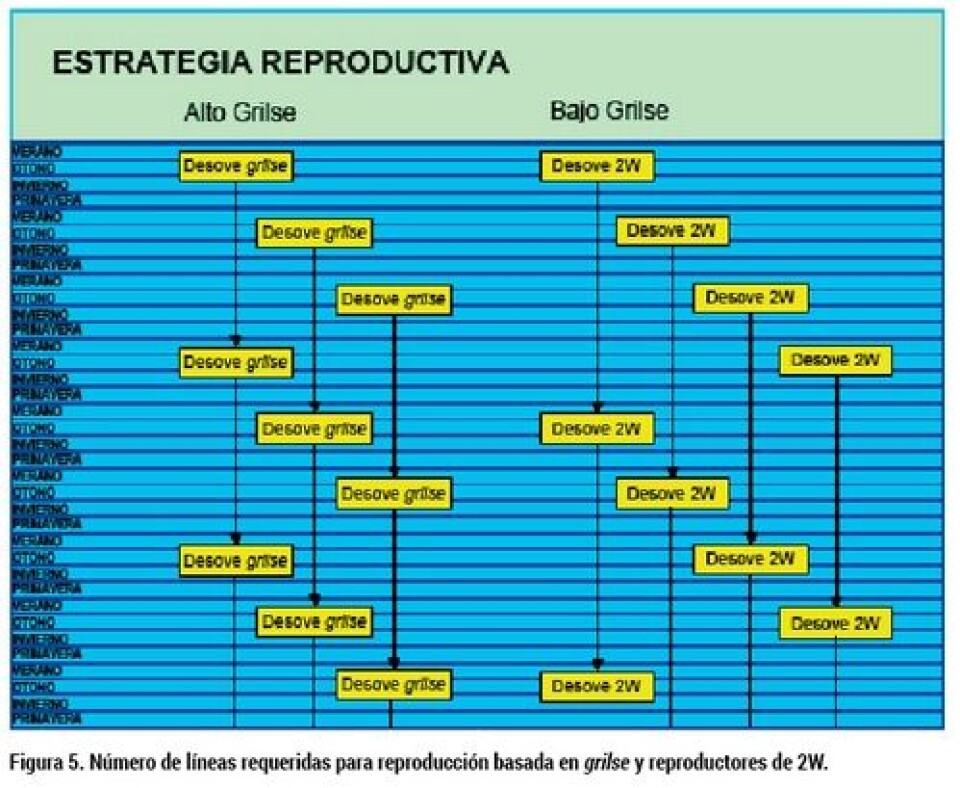
Crianza y reproducción de salmones La producción de salmones se ha adecuado al ciclo natural, adaptando el proceso natural a la conveniencia productiva, a través de la selección de cepas que presenten algunas características deseables, seguido de un posterior mejoramiento genético de las cepas silvestres inicialmente capturadas. Además de los esfuerzos por mejorar genéticamente las cepas, para adaptarlas a la producción intensiva, se han hecho grandes esfuerzos por desarrollar la nutrición y para desarrollar ingeniería que asegure condiciones de cultivo que maximicen la productividad. La estrategia de selección de cepas y manejo de la madurez que más se utilizó al momento de establecer líneas genéticas para los programas de reproducción y mejoramiento genético, fue la de preferir cepas que presentaban baja madurez grilse, para luego seguir reduciendo la madurez usando sólo peces maduros de dos, tres o más inviernos (2W y 3W). Esta estrategia, después de varias generaciones, reduce drásticamente la fracción de peces que maduran como grilse, especialmente si se usan reproductores de tres inviernos 3W o más. Esta modalidad reproductiva se implementó debido a que la madurez sexual deterioraba la calidad de los peces (pérdida de color plateado en la piel, pérdida de pigmentación de la carne), lo que obligaba la cosecha temprana de los peces en maduración, digamos entre la primavera y el inicio del verano, antes de que se afecte su calidad. La consecuencia de esto era que estos peces no alcanzaran la talla económica y apropiada para su comercialización. Ver esquema de la estrategia reproductiva para bajo grilse en figura 3. La estrategia alternativa a eliminar la ocurrencia de maduración temprana, fue exactamente la opuesta, generar líneas genéticas que se aproxime al 100% de grilse. Esto se logra mediante la reproducción de grilse generación tras generación (Figura 4). Para la implementación de esta estrategia se prefirió establecer la base genética a partir de la progenie de peces capturados que mostraban alta ocurrencia de grilse y, que a la vez, los grilse alcanzaran un peso apropiado para ser cosechados antes de mostrar deterioro de calidad debido a la madurez. La conveniencia de la estrategia de alto grilse se fundamentaba en que los peces que inician su madurez sexual en invierno, no muestran efectos de deterioro de la calidad hasta el inicio del verano , y durante todo ese tiempo los peces en maduración presentan velocidades de crecimiento mucho más altas que las de los peces inmaduros, dando como resultado un fuerte aumento en productividad (kg/smolt/mes). Como beneficio adicional, esta estrategia de alto grilse establece un ciclo de vida de tres años en comparación a cuatro, cinco o más años que toma un ciclo reproductivo que usa reproductores 2 SW, 3 SW o mayores, generándose ventajas en la velocidad con que se lograrían mejoras en el material genético a través de los programas de reproducción selectiva y, a su vez, se disminuye el número de líneas que requiere el programa de reproducción (ver figura 5). La desventaja de la producción basada en grilse es que la ventana de cosecha en los sistemas tradicionales se reduce a tres meses en el año, lo que obliga a tener una cepa distinta para la producción durante el resto del año. Sin embargo, los avances de las tecnologías de cultivo han ido proporcionando herramientas de manejo a través de fotoperiodo y cultivo en estanques recirculados, que permitirían producir el ciclo de alto grilse todo el año, aprovechando altas tasas de crecimiento alcanzadas en la premaduración, en las condiciones ambientales óptimas y con alta protección sanitaria.
La fase de agua dulce en la producción de salmones
Producción de ovas La producción en agua dulce parte con la necesidad del suministro de ovas. Las alternativas del productor para suplir esta necesidad, es contar con un plantel de reproductores con el número de líneas que permita la producción de ovas y semen todos los años y en la cantidad requerida. Alternativamente, el productor de agua dulce puede adquirir las ovas pre incubadas hasta el estado de ojo. Una hembra madura produce unas 1.100 ovas/kg y un macho maduro genera esperma suficiente para fertilizar de una y hasta diez hembras. Para calcular la población inicial de reproductores (smolts) para la producción de ovas requerida, se debe estimar (1) el peso de las hembras al momento del desove; (2) el porcentaje de hembras que se espera madure como grilse, 2W o 3 W, según sea la estrategia respecto a la madurez; (3) estimar el porcentaje (%) de supervivencia hasta el momento del desove; (4) asumir un porcentaje (%) de hembras en la población original, la que puede ser menor que 50% si la población de smolts tiene graduaciones por tamaño, un 40% es un número razonable; (5) considerar un factor de seguridad por perdidas inesperada de peces, y desoves de mala calidad; y, finalmente, (6) considerar un factor de aumento para dejar espacio a la selección de características fenotípicas u otras. Por ejemplo, en la Fórmula 1 para un stock de reproductores de un 50% de madurez, como 2W (bajo grilse), un peso al desove de 8kg, una sobrevivencia de 80% entre el estado de smolt hasta el desove, y 40% de hembras en los smolts, por cada millón de ovas verdes, se requerirían 710 smolts iniciales sin factor de seguridad y sin factor para permitir una selección por caracteres deseados. La consideración de estos factores tiene que ver con el nivel de seguridad con que se cuenta para la mantención de los reproductores y con el plan de selección de reproductores que se haya diseñado. El número de peces reproductores deben ser cultivados en condiciones ambientales seguras, de bajo estrés y bajo riesgo sanitario. Una vez que se pueda establecer el sexo de los peces, podría reducirse el número de machos, considerando el plan de desove requerido y el número de lotes de ovas (un lote de ova = una hembra) que se fertilizará con un macho. Para generar una nueva población de reproductores, se debe considerar un macho por hembra, y para generar una población de producción, se puede considerar tres hembras/macho.
En los inicios de la salmonicultura en Chile (y en el mundo, exceptuando algunos casos), la mantención de reproductores se realizaba, al igual que los peces de engorda, en balsas jaula en el mar, en un ciclo más largo, que permitía el inicio de la madurez mediado por el fotoperiodo natural. Una vez que los peces mostraban signos de madurez y se iniciaba la expresión de caracteres sexuales secundarios, los peces eran seleccionados en número y relación hembra/macho en función del plan de reproducción, y eran transportados a centros de agua dulce para esperar el término de la maduración y, finalmente, realizar la extracción de ovas y semen, así como la fertilización y llevar a cabo la revisión sanitaria de las carcazas, para la determinación de su condición sanitaria. Las ovas recién fertilizadas se mantenían en incubación individual de cada lote proveniente de una hembra. Si la hembra o el macho era encontrado positivo a una enfermedad de transmisión vertical, las ovas eran separadas y destruidas sanitariamente. Esta metodología funcionó muy bien mientras las condiciones sanitarias generales eran razonablemente buenas. Una variación en la metodología de obtención de gametos, que fue utilizada en algunas empresas en Chile, era inducir la madurez final de hembras y machos con hormona liberadora de gonadotropina (LHRH) o extracto de pituitaria liofilizada, y así evitar el traslado de los peces y, con ellos, enfermedades a agua dulce. Hoy en día, la producción de ova nacional ha cambiado radicalmente a partir de la crisis sanitaria del año 2007. Para hacer frente a las condiciones sanitarias más riesgosas, la industria mantiene las poblaciones de reproductores durante todo el ciclo de vida en estanques con sistemas de protección sanitaria que rebajan el riesgo de enfermedades. Esta modalidad no sólo permite dar más seguridad al sistema reproductivo, sino que también, potencialmente, permite realizar manejos de fotoperiodo y de temperatura para optimizar la producción y generar ovas fuera de temporada.
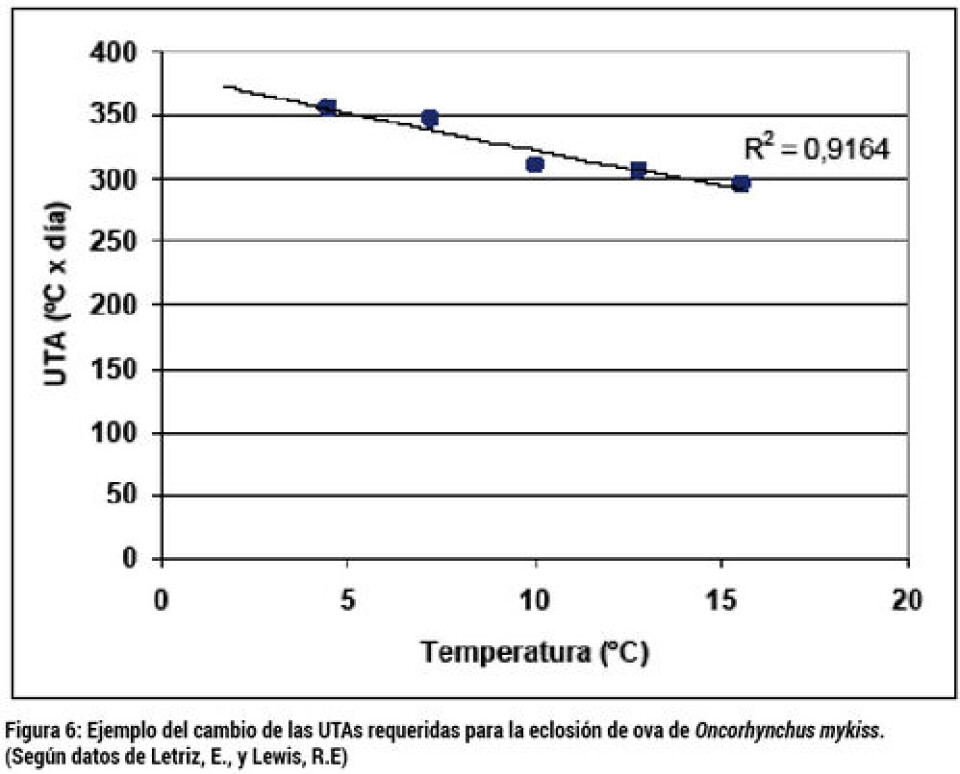
Proceso de incubación de ovas Existen dos etapas en la incubación de las ovas, desde la fertilización hasta la eclosión. La primera etapa se denomina incubación de ova verde. Se inicia con la ova recién fertilizada y termina en un estado de desarrollo intermedio llamado ova ojo, debido a que los ojos del embrión pueden distinguirse a través del corion. Al inicio de esta etapa, las ovas son muy sensibles al movimiento, por lo que la incubación se realiza sin manejos. La duración de esta fase depende de la temperatura de incubación. Para Salmo salar, el tiempo de esta etapa puede estimarse como 320 UTA (unidades térmicas acumuladas, o grados día), esto significa que se requerirá 64 días a 5ºC (320 °C×día/5 °C = 64 días) ó 40 días a 8 °C para llegar al estado de ova ojo. Una vez alcanzado el estado de ova ojo, un poco antes de las 320 UTA, las ovas son sometidas a un shock mecánico que permeabiliza el corion y precipita la proteína de las ovas muertas, revelándolas por el color blanco que desarrollan, para luego realizar su eliminación y conteo de las ovas ojo viables. Una vez hecho esto, las ovas ojo inician la siguiente etapa de incubación hasta la eclosión. La eclosión de Salmo salar ocurre aproximadamente a las 480 UTA, de manera que la incubación de ova ojo a eclosión a 5 ºC debiese durar: (480-320) °C×día/5 °C = 32 días, o 20 días a 8 °C. La eclosión de la ova libera un alevín que conserva parte del saco vitelino, el cual se absorbe al cumplir aproximadamente las 860 UTA, es decir, que a 5 °C el periodo de absorción del saco vitelino será: (820-480) °C×día/5 °C = 68 días, ó 42 días a 8 °C. Después de absorbido el saco vitelino, los alevines son traslados a estanques para su primera alimentación.

El cálculo de los tiempos requeridos para la incubación a través de las UTA es aproximado, ya que a distintas temperaturas, las UTAs requeridas cambian (figura 7). El manejo de la temperatura de incubación entrega al productor un grado de libertad para controlar el tiempo de incubación y, de esta manera, sincronizar lotes de diferentes desoves, separar lotes con distintas fechas de salidas a primera alimentación, así como atrasar o adelantar la producción. Sin embargo, hay que considerar que aunque las ovas de salmón Atlántico sobreviven entre 0 y 16 °C, temperaturas sobre 10 °C provocan un aumento de la mortalidad y la ocurrencia de deformidades. La temperatura máxima de incubación recomendable es 9 °C, sin embargo, se ha reportado que ovas incubadas entre 5 y 6 °C producen peces de mayor crecimiento y con mejor reclutamiento de fibra muscular que los peces generados por incubación a 10 °C o más (Stickland, 2007; Solomon y Lightfoot, 2008; Finstad y Jonson, 2012). Para el desarrollo de ovas, existe una gran variedad de incubadores (figura 6). Una observación importante es que el diseño del incubador debe asegurar que el agua se distribuya homogéneamente en la totalidad de las ovas que contiene. Una falla de esta condición puede provocar la muerte de ovas en sectores de mala irrigación y generarse crecimiento de hongos que empeoraran la situación, pudiendo llegar a perderse la totalidad de las ovas contenida en el incubador. Esto es especialmente crítico en algunos silos de incubación utilizados (ver incubador A, figura 7). La obturación del incubador tipo silo, por crecimiento de hongo, puede ocurrir también por mortalidad en lotes de mala calidad o por problemas en la calidad del agua.
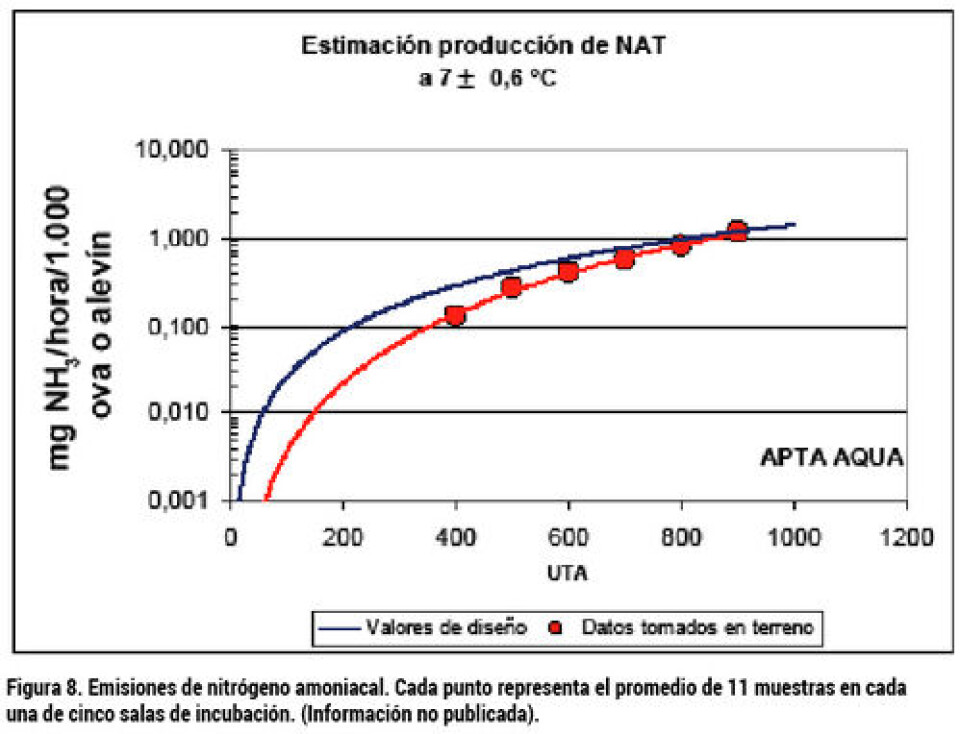

Control de la incubación y calidad de agua Como se ha adelantado, uno de los desafíos de la producción intensiva es poder mantener condiciones de calidad de agua apropiadas para lograr un buen resultado productivo. Las ovas en incubación generan desechos solubles CO2 y NH3, y consumen O2. Las emisiones y el consumo de O2 aumentan con el desarrollo del embrión. La figura 8 muestra un estimado para la emisión de nitrógeno amoniacal total (NAT) de ovas y alevines de saco incubados a 7 °C. Estas tasas de emisión pueden utilizarse para estimar cuál será la concentración de NAT en la incubadora dependiendo del diseño del sistema y la cantidad y calidad de agua utilizada. El NAT es la suma del contenido de nitrógeno del NH3 (amoniaco) y el NH4+ (amonio), los que se encuentran en equilibrio según sea el pH. De los componentes del NAT, el N-NH4+ es de baja toxicidad y el N-NH3 es altamente tóxico, recomendándose que no sobrepase 0,01 mg/L para el cultivo de salmón Atlántico. La relación entre el N-NH4+ y el NH3 está dado por la siguiente relación: EC01 NH3 + H+ NH4+
Y el porcentaje de N-NH3 en el total del NAT (suma de N-NH3 + N-NH4+) puede ser estimado de la ecuación EC02. EC02 [NH3]% = KNH3×10pH /(KNH3×10pH +1)
KNH3 es la constante de equilibrio de la reacción EC01 y se puede calcular como: EC03 KNH3 = 0,6084 × e-6.199,4/T Donde T es la temperatura en grados Kelvin.
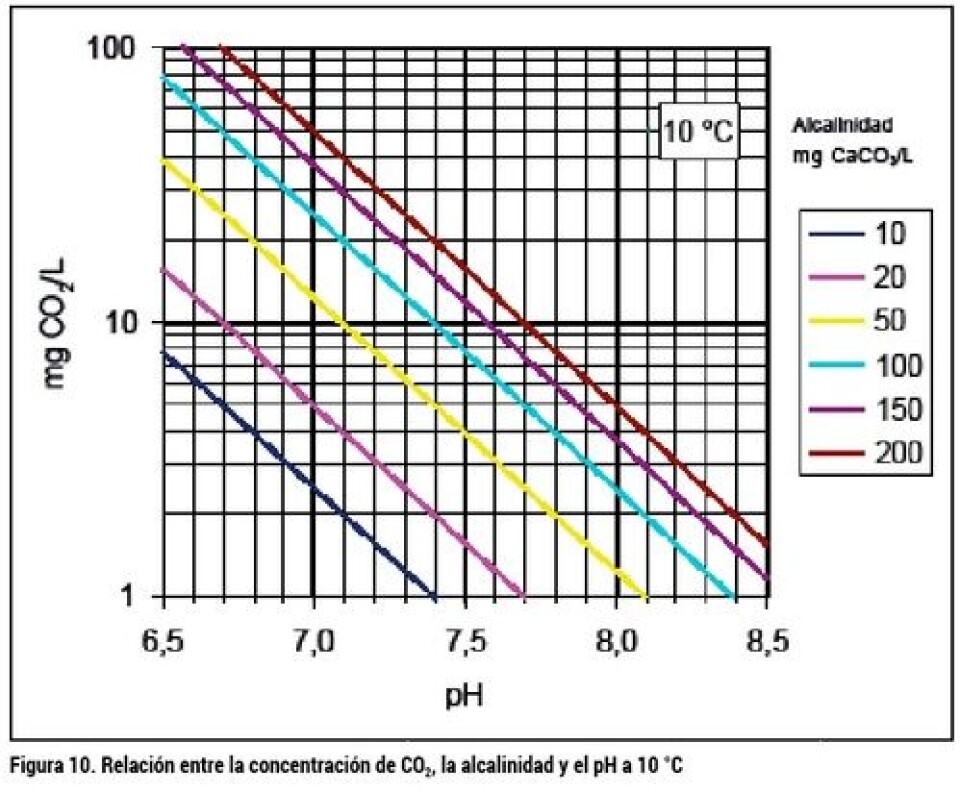
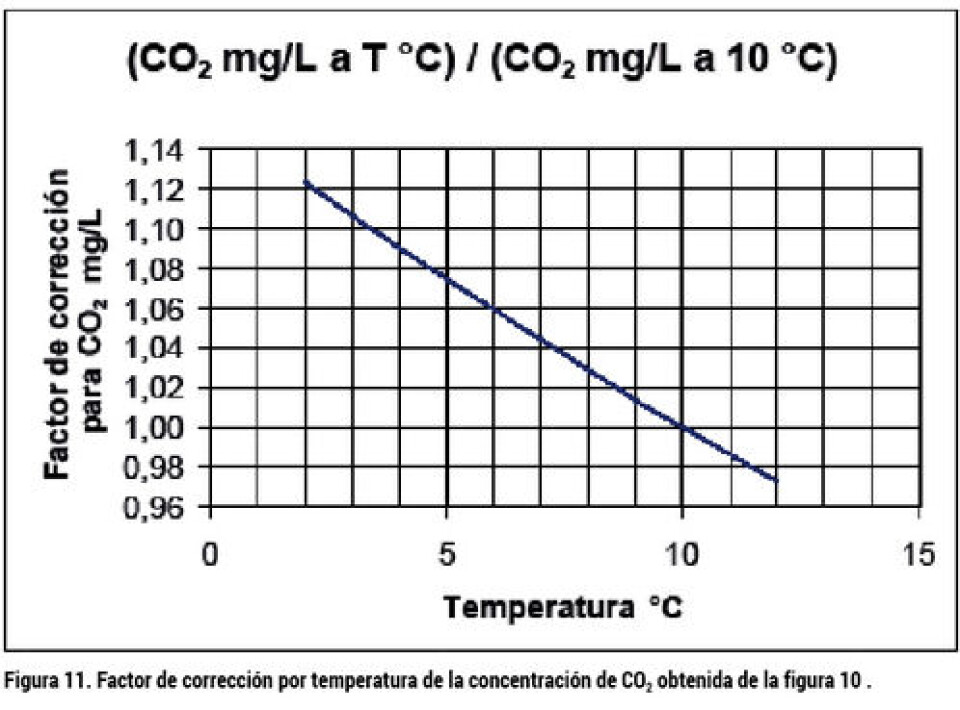
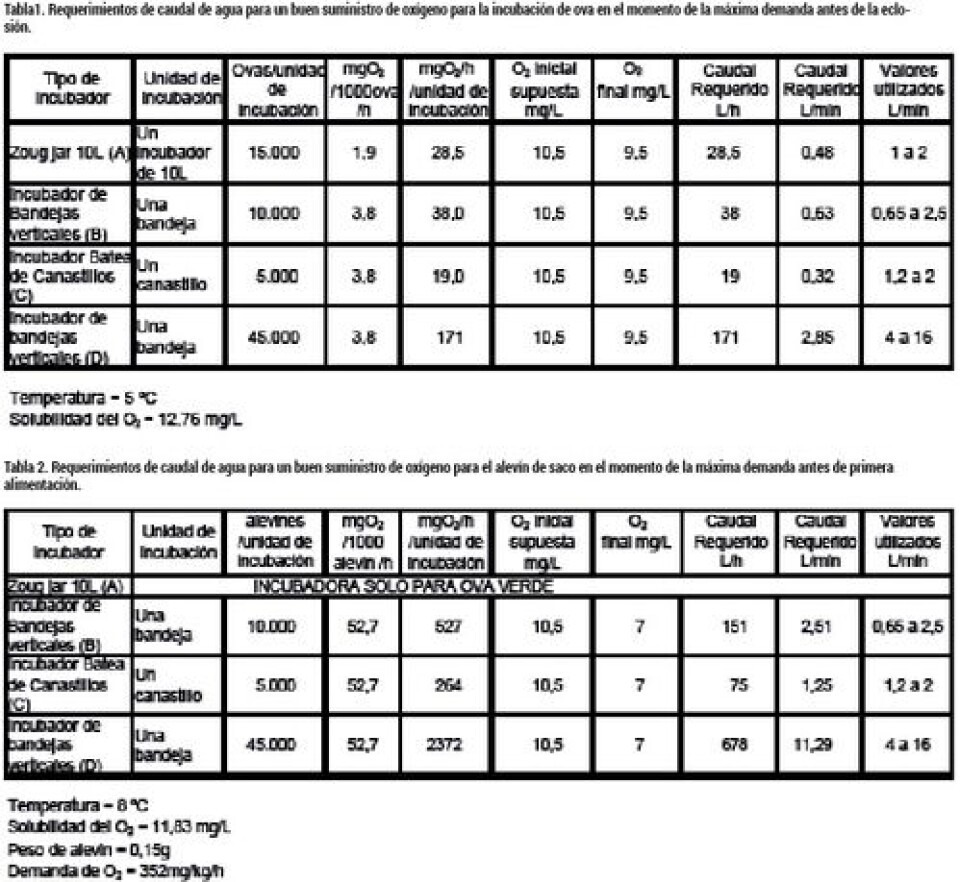
El resultado gráfico de la ecuación EC2 se muestra en la figura 9 para temperaturas entre 5 y 30 °C y pH entre 6,5 y 8,5. Como se puede ver en la figura 9, el pH ejerce un gran efecto sobre la disociación del amonio a amoniaco, de manera que a mayor pH, el NAT se torna más tóxico. El pH a su vez dependerá de la alcalinidad del agua utilizada, la temperatura y la concentración de CO2 según el equilibrio del sistema carbonato, tal como se muestra en la figura 10 a 10 °C. Si deseamos conocer la concentración de CO2 a temperaturas distintas a 10 °C, puede usarse la figura 11 para corregir, multiplicado la concentración a 10 °C por el factor a la temperatura deseada. El otro elemento importante a ser considerado en la incubación, es la concentración de oxígeno en el agua. Las ovas de salmón son particularmente sensibles a los bajos niveles de O2 en comparación con alevines, debido a la mayor resistencia a la difusión a través del corion y el fluido perivitelino. La deficiencia de oxígeno disminuye la tasa de desarrollo y provoca eclosión prematura. La demanda de oxígeno de las ovas es del orden de 2,4 a 3,8 mg O2/1.000 ovas/h a 5 °C, antes de la eclosión (Greig, 2005), y a 10 °C según la activación térmica respiratoria de los alevines (Wedemeyer, 1996), debiese ser un 88% mayor 4,5 a 7,2mg/1000 ovas/h. A su vez, los alevines de primera alimentación tienen una demanda aproximada de oxigeno de entre 200 y 220 mg/kg/h a 5 °C, y 370 a 420 mg/kg/h a 10 °C. (Wedemeyer, 1996). De acuerdo con estas demandas, asumiendo 5 °C para la incubación de ovas y 9 °C para los alevines de saco, se calcularon los caudales de agua de la tabla 1, requeridos para las incubadoras de la figura 7 para ovas hasta la eclosión, y los requerimientos de caudal de agua para estas incubadoras, para el proceso de absorción de saco, se muestran en la tabla 2. Según los resultados de la tabla 1, el suministro de agua normalmente utilizado está bastante en exceso respecto del caudal requerido a 5 °C y con la carga máxima especificada. Bastante ajustados están los caudales recomendados respecto de los calculados al final de la incubación de los alevines de saco a 9 °C en la tabla 2, especialmente para el incubador de bandejas verticales (B). Note que en el cálculo de la tabla 2 se permitió un nivel menor de oxígeno debido a que ya han desaparecido las restricciones difusionales del corion.
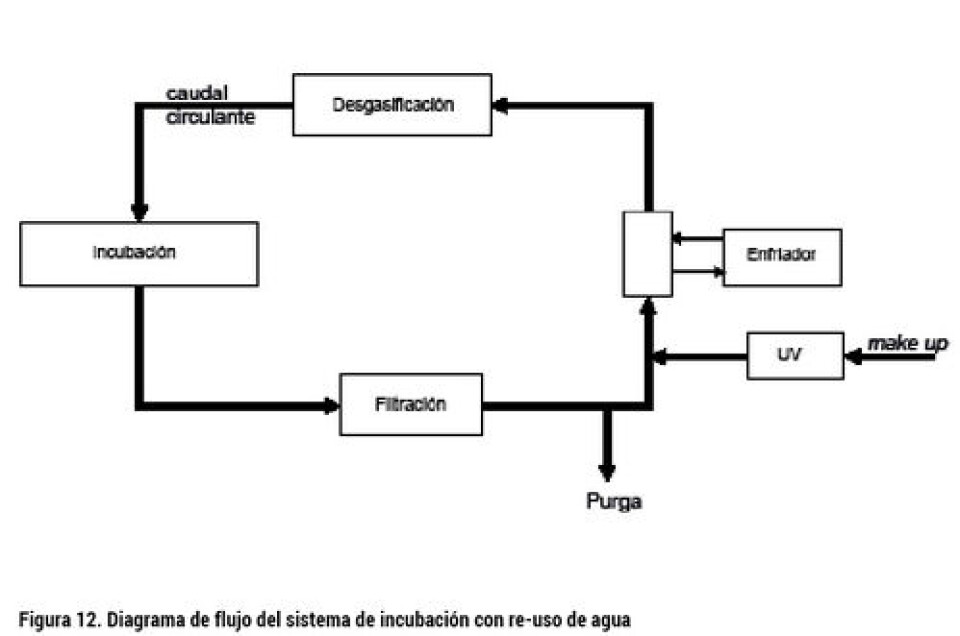
Adicionalmente a la revisión de los caudales requeridos para el suministro de oxígeno, la incubación debe considerar varios aspectos adicionales: (1) control de la temperatura de incubación; (2) evitar la entrada de sedimentos que pueden disminuir la capacidad de transferencia de oxígeno a través del corion; (3) desinfectar el agua alimentada al sistema de incubadores; (4) cuidar que el nivel de amoniaco no sobrepase los 0,01 mg/L aceptado como límite, aunque niveles de 0,005mg/L es el límite inferior de NH3 con efectos subletales que ya desaceleran el desarrollo larval (Finn, 2007) El diseño más utilizado para cumplir con el nivel de control requerido a un costo energético mínimo, es el sistema de re-uso de agua, consistente en el tratamiento del agua que ha pasado por la incubadora mediante filtración, desgasificación, y control de la temperatura (normalmente enfriamiento) para luego reemplazarla parcialmente antes de re-alimentarla a los incubadores. El nivel de reemplazo varía normalmente entre 5 y el 20%, dependiendo tanto del estado de avance del desarrollo de la incubación (UTA) como de la temperatura utilizada y la calidad de agua de ingreso, principalmente, respecto de su alcalinidad y nivel de nitrógeno amoniacal. Según los resultados de la tabla 1, el suministro de agua normalmente utilizado está bastante en exceso respecto del caudal requerido a 5 °C y con la carga máxima especificada. Bastante ajustados están los caudales recomendados respecto de los calculados al final de la incubación de los alevines de saco a 9 °C en la tabla 2, especialmente para el incubador de bandejas verticales (B). Note que en el cálculo de la tabla 2 se permitió un nivel menor de oxígeno debido a que ya han desaparecido las restricciones difusionales del corion. Adicionalmente a la revisión de los caudales requeridos para el suministro de oxígeno, la incubación debe considerar varios aspectos adicionales: (1) control de la temperatura de incubación; (2) evitar la entrada de sedimentos que pueden disminuir la capacidad de transferencia de oxígeno a través del corion; (3) desinfectar el agua alimentada al sistema de incubadores; (4) cuidar que el nivel de amoniaco no sobrepase los 0,01 mg/L aceptado como límite, aunque niveles de 0,005mg/L es el límite inferior de NH3 con efectos subletales que ya desaceleran el desarrollo larval (Finn, 2007) El diseño más utilizado para cumplir con el nivel de control requerido a un costo energético mínimo, es el sistema de re-uso de agua, consistente en el tratamiento del agua que ha pasado por la incubadora mediante filtración, desgasificación, y control de la temperatura (normalmente enfriamiento) para luego reemplazarla parcialmente antes de re-alimentarla a los incubadores. El nivel de reemplazo varía normalmente entre 5 y el 20%, dependiendo tanto del estado de avance del desarrollo de la incubación (UTA) como de la temperatura utilizada y la calidad de agua de ingreso, principalmente, respecto de su alcalinidad y nivel de nitrógeno amoniacal. La figura 12 muestra un diagrama de un sistema de incubación con reuso de agua. El agua de salida de las incubadoras es filtrada y reciclada parcialmente al sistema de tratamiento y suplementada con agua fresca desinfectada. La mezcla constituye el total del agua circulante, por lo que la purga es igual al suplemento o make up. El agua es entonces enfriada (controladamente) a la temperatura de incubación y luego desgasificada para eliminar controladamente CO2, para ser alimentada a las incubadoras cerrando el circuito.
La tabla 3 muestra un balance de la situación suponiendo un millón de ovas en estado previo a la eclosión, e incubadas a 5 °C. En esas condiciones, el consumo de O2 es 3,8 mg/1000 ova/h y el de CO2 es estimado como 1,375 veces el consumo de O2. El caudal circulante se fijó en el necesario para una incubadora de bandejas verticales de 171L/h por cada 45.000 ovas resultando en 3.800 L/h Para la calidad del agua se supuso una alcalinidad de 100 mg CaCO3/L, 1mg/L de CO2, y 0,2mg/Lde NAT. Para el balance de CO2 se fijo el pH de 7,5, con lo cual la concentración de CO2 debiese ser de 8 mg/L (de la figura 10 y corrección con figura 11). Para mantener el nivel de CO2 en 8 mg/L, con una producción de 5.225 mg/h, se requiere un caudal de 746 L/h, un 19,6% de makeup. Para el balance de NAT se determinó una emisión específica de 0,3 mg/1000 ova/h (figura 8), lo que para un millón de ovas resulta en 300 mg/h. La concentración máxima recomendada de N-NH3 es de 0,01mg/L, y el porcentaje de N-NH3 en el NAT a pH 7,5 es de 0,4%, por lo que el NAT aceptable es de 2,5mg/L y el make up requerido para su eliminación (por la purga) sería de 130L/h, sólo un 3,4% del caudal circulante. De acuerdo con el resultado, podemos trabajar con un reemplazo mayor al 3,4%, asegurando que el nivel de N-NH3 será menor a 0,01mg/L, y menor reemplazo de agua que el indicado por el balance de CO2, ya que se cuenta con un desgasificador que puede eliminar el exceso. Un make up entre 5 y 10% sería seguro para esta instalación hipotética, para mostrar la relación de las distintas variables que participan en el diseño operativo. Referencias Finn, Roderick Nigel. (2007) The physiology and toxicology of salmonid eggs and larvae in relation to waterquality criteria. Aquatic toxicology 81: 337-354 Finstad, Anders G. And Jonsson, Bror. (2012) Effect ofincubation temperature on growth performance in Atlantic salmon. Mar. Ecol. Prog. Ser 454:75-82 Greig, S.M., Sear, D.A., Smallman, D. and Carling, P.A. (2005) Impact of clay particles on the cutaneous exchange of oxigen across the chorion of Atlantic salmon eggs. Leitritz, Earl. and Lewis, Robert C. (1980) Trout and Salmon Culture: Hatchery Methods. California Fish Bulletin Number 164. University of California Solomon, David and Lightfoot, Graham. (2008) The thermal biology of brown trout and Atlantic salmon. Science Report, SCHO0808BOLV-E-P, Environment Agency UK