Revisión sobre la evidencia de transmisión vertical de Piscirickettsia salmonis
Julio Larenas1, Jacqueline Quinteros1, María Teresa Calderón2, Mariana Acuña1 1 Universidad de Chile. Laboratorio Nacional de Referencia para el diagnóstico de enfermedades de especies hidrobiológicas, Facultad de Ciencias Veterinarias y Pecuarias. juliolarenas@gmail.com 2 Universidad Mayor.
Introducción A pesar de que la Piscirickettsiosis y su agente etiológico fueron descritos hace aproximadamente 25 años (Bravo y Campos, 1989; Fryer y col., 1990; Cvitanich y col., 1991), poco se conoce sobre la patogenia de la enfermedad, incluyendo los mecanismos de transmisión, tanto vertical como horizontal. En el presente trabajo se hace una revisión y análisis de la información relevante relacionada con la transmisión vertical de Piscirickettsia salmonis.
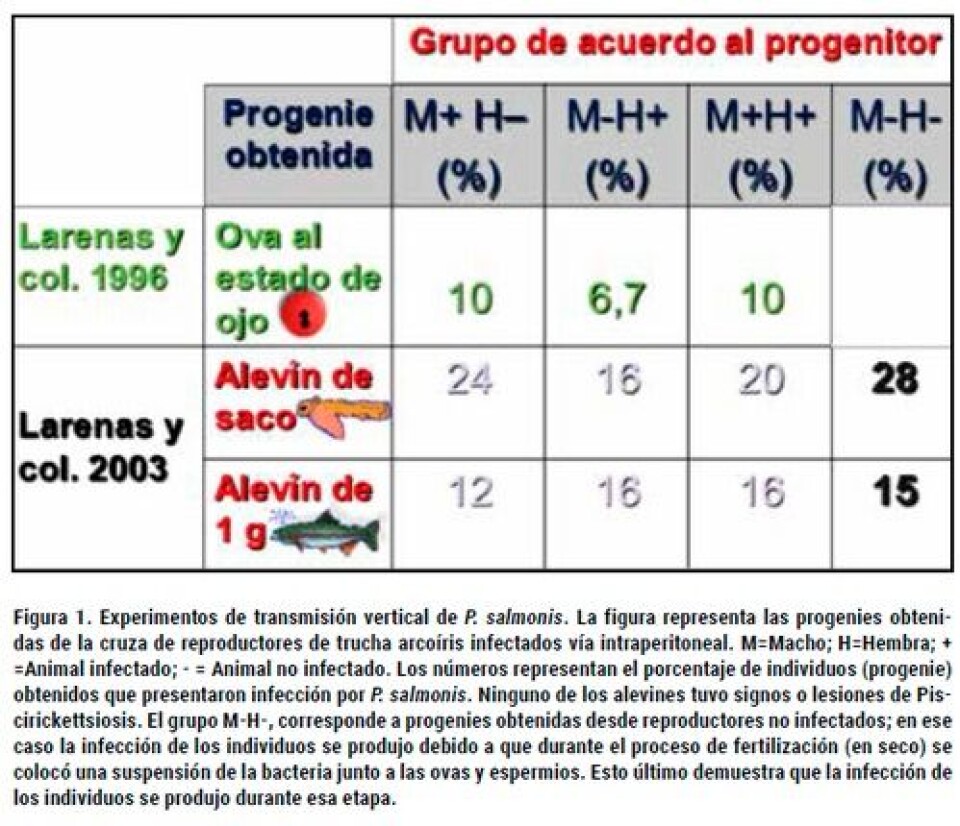
Antecedentes de transmisión vertical Cvitanich y col., (1991), fueron los primeros en detectar la presencia del P. salmonis en ovarios, fluido ovárico y testículos de peces infectados in vitro. Posteriormente, Bravo (1994) describió el primer caso de Piscirickettsiosis en agua dulce, que afectó a truchas arcoíris provenientes de ovas importadas desde los Estados Unidos y cultivadas en el lago Llanquihue. Estos peces mostraron los signos y síntomas clínicos correspondientes con la enfermedad. El diagnóstico fue confirmado mediante la prueba de inmunofluorescencia indirecta, donde se detectó al microorganismo en frotis de diferentes órganos de peces enfermos, incluso en gónadas. Por lo tanto, basándose en esos antecedentes, la autora sugirió la posible existencia de la vía vertical como forma de transmisión de la enfermedad, pero reconoció la necesidad de profundizar más en este punto. La vía vertical, también fue sugerida por Bustos y col. (1994) apoyados en sus resultados experimentales, pero éstos no fueron concluyentes, debido principalmente a que los grupos controles negativos también aparecieron infectados con P. salmonis. En forma experimental, Larenas y col. (1996), obtuvieron ovas al estado de ojo infectadas con la bacteria, las cuales provenían de la cruza entre reproductores de trucha arcoíris machos y/o hembras inoculados intraperitonealmente (IP) con el microorganismo. La explicación del experimento se muestra en la Figura 1. La bacteria fue encontrada, mediante IFAT, en escasa a moderada cantidad dentro de la ova y fluido celómico, así como en el fluido seminal de reproductores inoculados. En un estudio realizado por Larenas y col. (2003) demostraron que las progenies de machos y/o hembras reproductores inoculados vía intraperitoneal (IP) con la cepa LF-89 de P. salmonis, generaron la infección de alevines de saco y de 1 g de peso viables (Figura 1). Además, lograron obtener alevines infectados a partir de la exposición de gametos, provenientes de reproductores no inoculados, con una suspensión de la bacteria durante la fertilización, lo cual indicaría que el patógeno ingresa a la ova durante este proceso, independiente de si la muestra había tenido o no contacto con semen. Por lo tanto, concluyeron que los espermatozoides no son un factor determinante en la transmisión vertical, a diferencia de otras enfermedades bacterianas de transmisión vertical, como BKD (Bacterial Kidney Disease), en relación a esto, Evelyn y col. (1985), han demostrado la importancia del espermatozoide en la transmisión vertical de R. salmoninarum, sugiriendo que la penetración de esta bacteria sería a través del micropilo, facilitado por los movimientos del espermatozoide. Para ello realizaron un estudio donde sumergieron ovas en fluido ovárico que contenía R. salmoninarum, para poder demostrar que la entrada del agente dentro de la ova era través del micropilo, debido a que la bacteria es de un diámetro pequeño (0,4 - 0,8 µm), por lo que podría pasar a través de él.
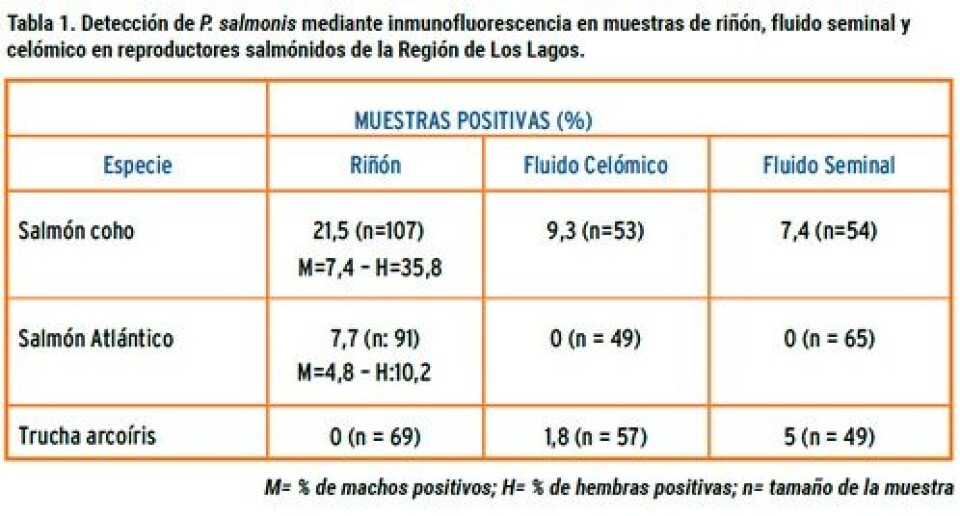
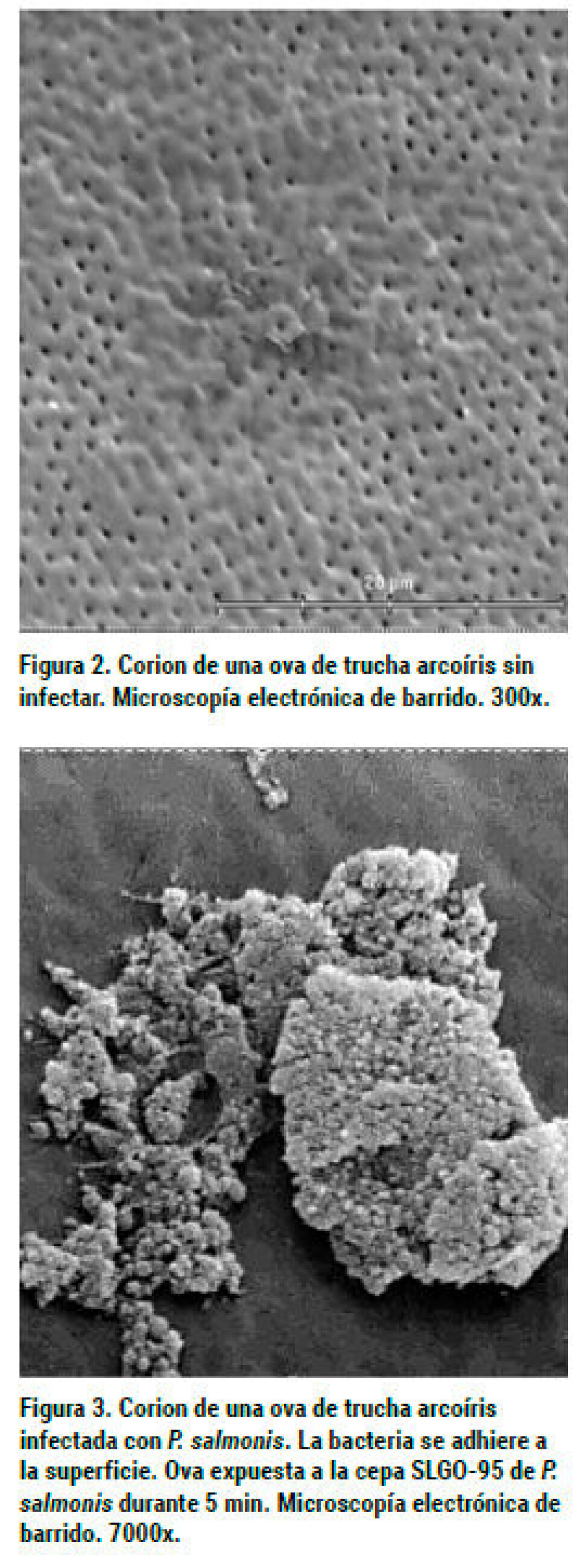
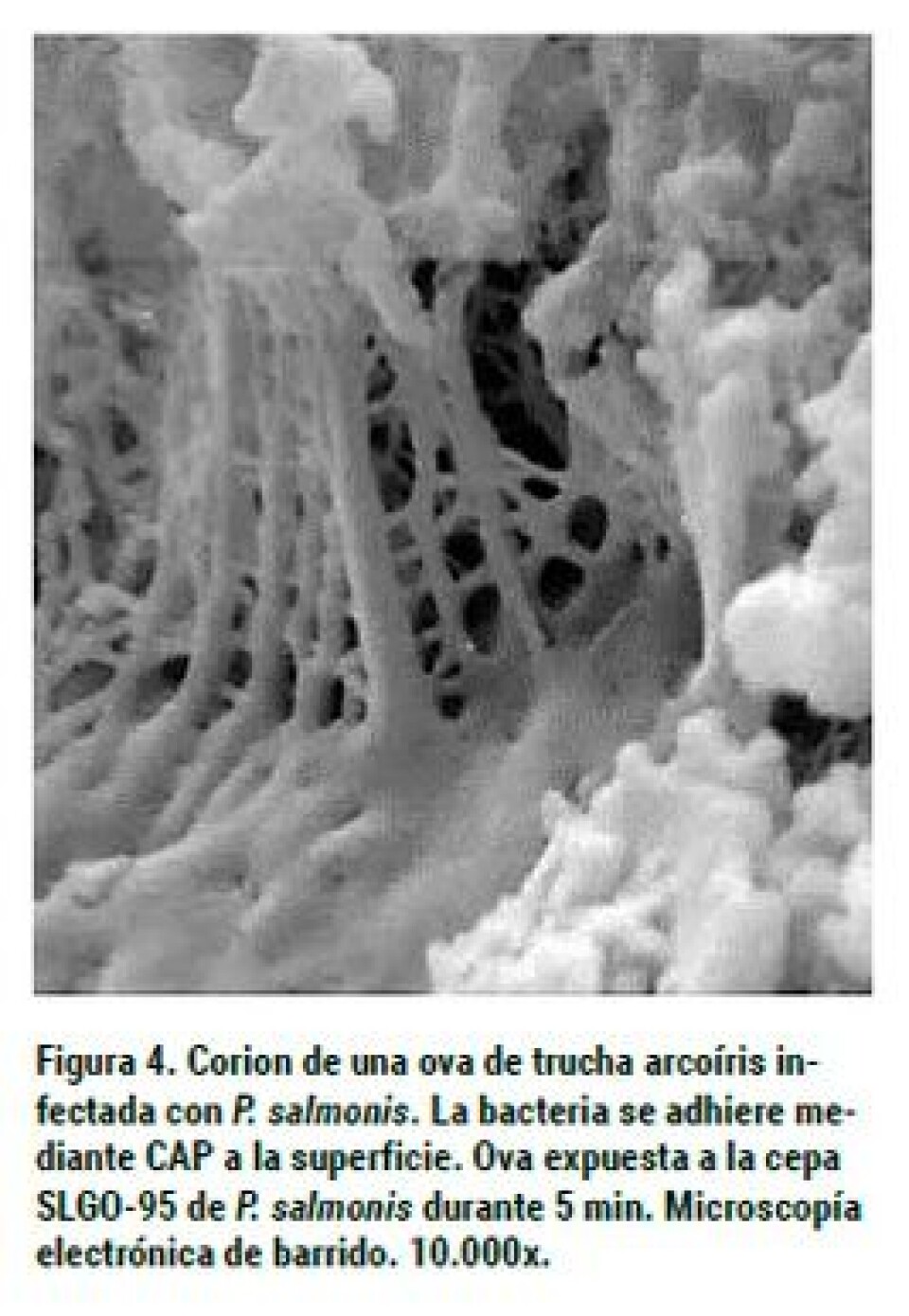
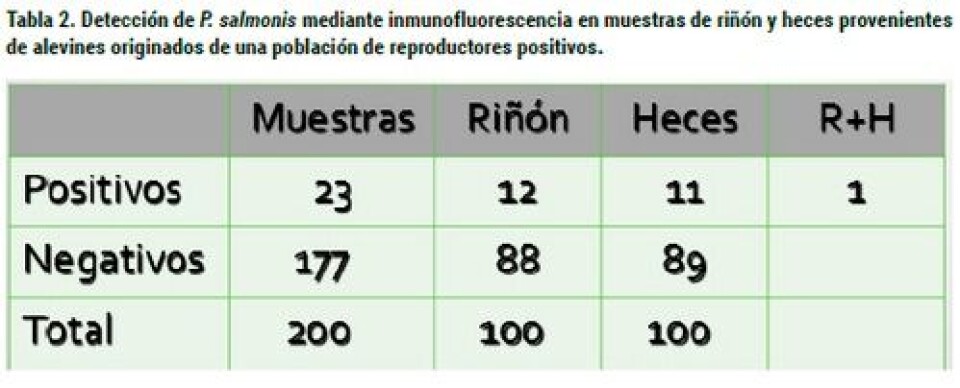
Larenas y col, (2003) observaron que los reproductores, aun cuando se infectan, no hacen Piscirickettsiosis clínica, actuando como portadores sanos y diseminadores de la Piscirickettsiosis a las progenies. Sin embargo, en trabajos realizados en nuestros laboratorios (no publicados) hemos logrado mortalidades en truchas reproductoras, inoculadas IP con la cepa SLGO-95, lo cual se explicaría por la mayor virulencia de este aislado en comparación a LF-89. Mediante el uso de microscopía electrónica de barrido, se ha observado que a los 45 segundos de contacto de las ovas con la bacteria, ésta puede adherirse a su superficie mediante unas prolongaciones, que probablemente se originan desde la membrana externa de P. salmonis, a las cuales se les denominó “Complejo de Adhesión Piscirickettsial” (CAP). En tanto, a los cinco minutos de exposición, se evidenciaron bacterias dentro de la ova. Además, fue posible observar que estas estructuras emiten prolongaciones que permiten unirse entre las bacterias. Estos CAP fueron demostrados en la cepa LF-89 (Larenas y col., 2003). Los autores plantean la hipótesis de que el agente tiene que tener una “estrategia” que le permita rápidamente ingresar a la ova, la cual le daría una protección y un ambiente adecuado, lo que se corrobora por el hecho de que al segundo tiempo estudiado (5 min.) las bacterias fueron observadas en el interior de la ova. No existen evidencias de una penetración de P. salmonis a través del micropilo, como se ha establecido para el caso del BKD (Evelyn y col., 1985). En trabajos aún no publicados hemos establecido que la cepa SLGO-95 de P. salmonis es capaz de adherirse a las ovas de trucha arcoíris al igual a que la cepa tipo LF-89, presentándose mayoritariamente en grupos y aparentemente en mayor cantidad que LF-89, lo que podría ser explicado por su mayor virulencia (Figuras 2, 3 y 4). Para establecer si la bacteria se puede encontrar en fluidos celómico y seminal de reproductores de salmónidos provenientes de centros de cultivo, se tomaron muestras de tres especies: salmón Coho, trucha arcoíris y salmón Atlántico. Los resultados se muestran en la tabla 1. Como se puede observar, tanto en salmón coho como en trucha arcoíris fue posible establecer la eliminación de la bacteria en fluidos seminales y celómicos. En trucha arcoíris, llama la atención la ausencia de detección en riñón, muestra utilizada habitualmente para establecer el diagnóstico de la infección por P. salmonis. En un experimento posterior (Larenas y col., 2005), se tomaron alevines provenientes de las cruzas de salmón Coho y fueron monitoreadas por un periodo de dos meses. Los resultados se muestran en la tabla 2. Los peces no presentaron signos clínicos durante la fase de cuarentena de tres semanas. Los 100 alevines eutanasiados y analizados, no evidenciaron alteraciones anátomo-patológicas a la necropsia y los frotis de riñón presentaron escasa a regular cantidad de R. salmoninarum a la prueba de IFAT. A su vez, frente a P. salmonis, los frotis renales (R) fueron positivos en un 12% y los de heces (H) en un 11%. De acuerdo con estos resultados, sólo un alevín fue positivo para ambas muestras (R+H+). Según lo descrito anteriormente, y basándonos en los resultados obtenidos, estos indicarían que los alevines de salmón Coho, provenientes de la cruza de reproductores machos y hembras positivos, se infectan vía vertical y eliminan la bacteria vía fecal, actuando como portadores asintomáticos de P. salmonis y, por ende, favoreciendo la diseminación del agente patógeno en condiciones naturales de cultivo, aun cuando sus muestras de riñón resulten negativas a la presencia de P. salmonis. En conclusión, podemos establecer que la información sobre la transmisión vertical es escasa, sin embargo, la evidencia experimental y de terreno indica que ésta se produce, aunque se desconoce su importancia epidemiológica. Aparentemente, los alevines que se encuentran infectados por esta vía, no demuestran signos clínicos, pero pueden diseminar el agente a través de las heces. Además, es importante destacar que, en general, los peces reproductores no se ven afectados por la enfermedad, salvo en aquellos casos donde la virulencia de la bacteria es alta. En tanto, el semen podría ser un factor de diseminación del microorganismo y, potencialmente, se puede constituir en un factor de riesgo para zonas libres de la enfermedad o de una determinada cepa.
Referencias Bravo S., Campos M. 1989. Coho salmon syndrome in Chile. Fish Health Section/American Fisheries Society Newsletter 17: 3. Bravo S. 1994. Piscirickettsiosis in freshwater. Bull. Eur. Assoc. Fish Pathol. 14:137-138. Bustos P., Entrala P., Montaña J., Calbuyahue J. 1994. Septicemia rickettsial salmonídea (SRS): Estudio de transmisión vertical en salmón coho (Oncorhynchus kisutch). En: Seminario internacional “Patología y Nutrición en el Desarrollo de la Acuicultura: Factores de éxito. Fundación Chile. Puerto Montt, Chile. Cvitanich, J. D., Garate O., Smith C. E. 1991. The Isolation of a Rickettsia-like Organism Causing Disease and Mortality in Chilean Salmonids and Its Confirmation by Koch’s Postulate. J. Fish Diseases 14: 121–145. Evelyn T., Prosperi-Porta L., Ketcheson J. 1985. Experimental Intra-Ovum Infection of Salmonid Eggs with Renibacterium Salmoninarum and Vertical Transmission of the Pathogen with Such Eggs despite Their Treatment with Erythromycin. Dis. Aquat. Org. 1: 197–202. Fryer, J.L., Lannan C., Garcés L.H., Larenas J.J., Smith P.A. Isolation of a rickettsia-like organism from diseased coho salmon (Oncorhynchus kisutch) in Chile. Fish Pathol. 25:107-114. Larenas J.J., Astorga C., Contreras J., Smith P. 1996. Detección de Piscirickettsia salmonis en ovas fertilizadas provenientes de trucha arcoíris (Oncorhynchus mykiss) experimentalmente infectados. Arch. Med. Vet. 28:161-166. Larenas, J., Hidalgo L., Garcés H., Fryer J.L., Smith P. 1995. Piscirickettsiosis: Lesiones en salmón del Atlántico (Salmo salar) infectados naturalmente con Piscirickettsia salmonis. Avances en Ciencias Veterinarias 10: 53-58. Lannan, C., Fryer J.L. 1993. Piscirickettsia salmonis, a Major Pathogen of Salmonid Fish in Chile. Fisheries Research 17: 115–121. Larenas, J.J., Bartholomew J., Troncoso O., Ledezma H., Fernández S., Vera P., Contreras J., Smith P. 2003. Experimental vertical transmission of Piscirickettsia salmonis and an in vitro study of the attachment and mode of entrance of the bacterium into the fish ovum. Dis. Aquat. Org. 56: 25-30. Larenas J., Zamorano E., Smith P. 2005. Detección de Piscirickettsia salmonis en heces de alevines de salmón coho (Oncorhynchus kisutch) infectados por transmisión vertical. Mon. Electr. Patol. Vet. 2: 59-67.




















