Técnicas para la evaluación de la esmoltificación y para la calidad de smolt
Aprendiendo Acuicultura está compuesta por una serie de artículos destinada a quienes tienen una participación activa en la industria acuícola. Esta sección está organizada con el propósito de entregarle información que esperamos encuentre útil en su trabajo diario, pues cuanto más conocimiento tenga, mejor podrá optimizar las condiciones de los peces y, un mejor bienestar animal, conduce a un desempeño más productivo y sustentable. Quisiéramos recibir sus observaciones y comentarios acerca de esta serie y apreciaremos sus sugerencias para futuros temas que le gustaría ver abordados aquí. Por favor envíenos sus comentarios a contacto@salmonexpert.cl
Alexis Martínez H. Laboratorio Antares S.A (Alab) alexis.martinez@alab.cl
Introducción En la edición anterior, revisamos la biología de la esmoltificación y los cambios que experimentan los peces en esta etapa. Los salmónidos naturalmente esmoltifican en primavera, pero en condiciones de cultivo, los productores llevan a los peces a realizar este proceso de enero a diciembre. De hecho, algunas empresas producen smolt todos los meses. Como veremos en capítulos posteriores, si se tiene control de la temperatura y la luz, se puede esmoltificar independientemente de la temporada, sin embargo, se recomienda que la temperatura máxima para esmoltificar no supere los 15 °C, con temperaturas superiores a ésta, no se han visto buenos resultados en la industria, y así lo demuestran algunos reportes científicos en condiciones controladas (Handeland y col., 2000) Realizar una óptima esmoltificación es un tema que cobra cada día mayor relevancia entre los productores de salmónidos, ya que hay mayor conciencia acerca de la fuerte asociación entre enviar peces al mar dentro de la ventana de esmoltificación y el rendimiento de éstos durante los primeros meses en su nuevo ambiente. No obstante, la inexistencia de un indicador o índice confiable conlleva a que lotes de peces lleguen a centros de mar sin estar en óptimas condiciones fisiológicas (o con alta dispersión en la calidad de smolt), resultando en pérdida de crecimiento, menor eficiencia de alimentación y elevadas mortalidades por incapacidad osmorregulatoria asociada con una mayor susceptibilidad a enfermedades contagiosas.
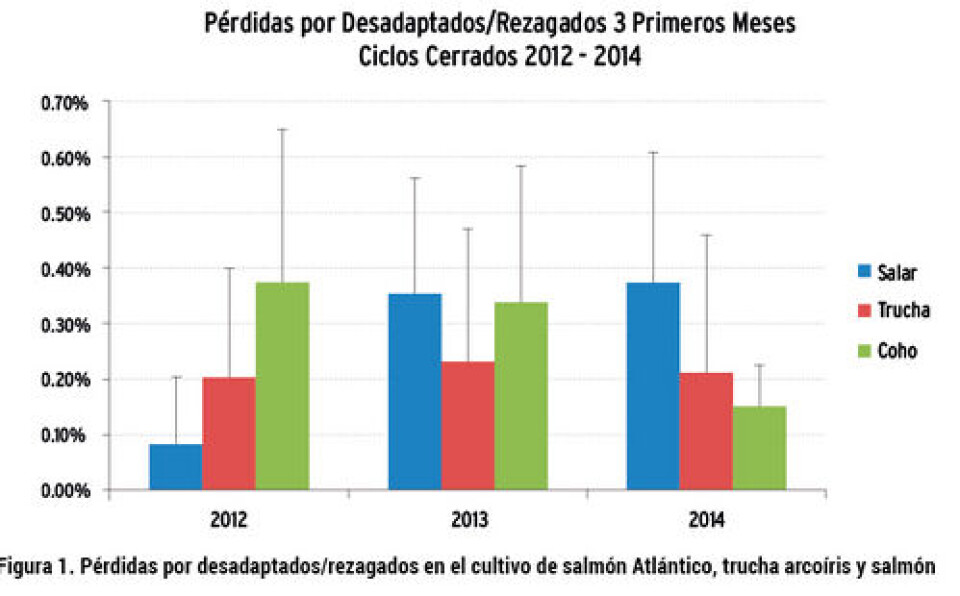
Se han identificado dos problemas principales en esta etapa, que repercuten directamente en los rendimientos productivos en el mar: el primero, una inadecuada esmoltificación que se ve reflejada en una falla en la osmorregulación, estos peces son conocidos comúnmente como desadaptados o “stunt” y se caracterizan por presentar una elevada mortalidad en los primeros días de ingreso al agua salada. El segundo problema es menos conocido y corresponde a peces que han esmoltificado, sin embargo, se caracterizan por ser peces de baja condición corporal, que crecieron solamente durante las primeras fases de cultivo pero se desconoce la razón por la que dejaron de hacerlo, éstos son los llamados peces rezagados o “parr-revertants” y son una complicación adicional, ya que presentan una mayor susceptibilidad a las infecciones y pasan a constituir reservorios de patógenos para la población sobreviviente. En la Fig. 1 se puede observar la evolución de las pérdidas o mortalidad en los primeros tres meses de trasladados al mar asociadas con desadaptados/rezagados en los últimos tres años. La mortalidad pos ingreso al mar y hasta los tres primeros meses de cultivo ha ido en aumento en salmón Atlántico, mientras que para la trucha arcoíris se ha mantenido alta y sólo ha ido disminuyendo en Coho. El impacto que podrían tener estos problemas relacionados con la esmoltificación es de gran envergadura para la industria salmonicultora, ya que, en el artículo 24 A del DS 319/2001 (RESA), la clasificación de bioseguridad de los centros de engorda dependerá del nivel de las pérdidas de peces producidos durante el ciclo productivo inmediatamente anterior, lo que incidirá en el número de ejemplares a ingresar al centro de cultivo en el ciclo productivo siguiente, conforme a los tramos de clasificación establecidos por la Subsecretaría de Pesca y Acuicultura en su resolución N° 1503/2013 (Tabla 1). De esta forma, los niveles de producción de cada empresa o Agrupación de Concesiones de Salmónidos (ACS) en Chile dependen, principalmente, del desempeño sanitario y de la calidad de los peces que ingresan al mar, siendo la calidad de los smolts un prerrequisito importante para contribuir al éxito productivo actual y futuro.
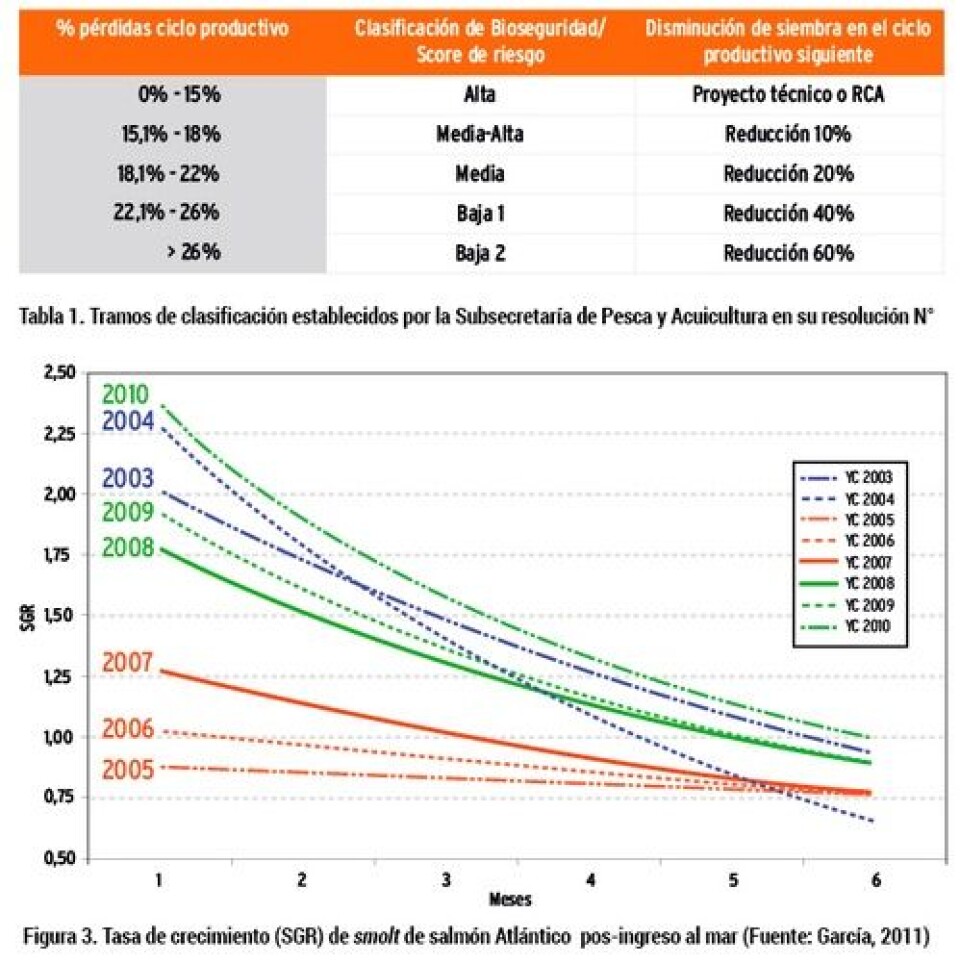
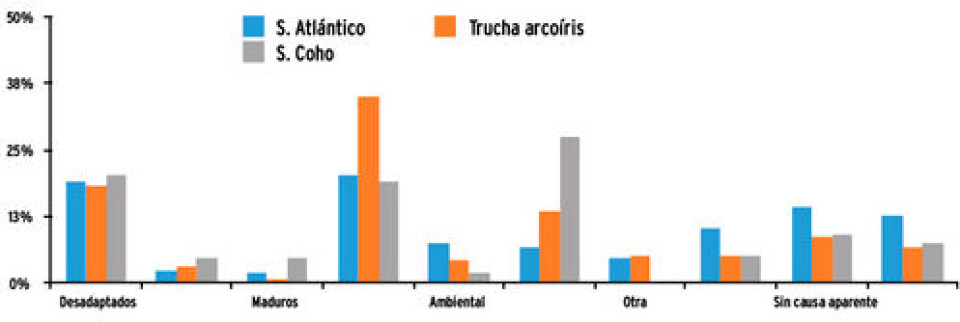
Mortalidad asociada con desadaptados De acuerdo con el informe sanitario de la salmonicultura 2013, realizado por el Servicio Nacional de Pesca y Acuicultura (Sernapesca), según la distribución porcentual de la clasificación de mortalidad asociada a causas primarias por especie, entre las causas de mayor pérdida en agua de mar se encuentra aquella asociada con peces desadaptados (Fig.2)
Calidad de Smolt Previa a la crisis del virus ISA en Chile, la industria crecía a un ritmo superior al 20% anual, por lo que la presión en el sistema de producción de agua dulce fue muy fuerte. Dado que, cuando se planifican las toneladas de biomasa a producir por una empresa, se debe considerar que el proceso comienza desde la ova hasta la siembra de smolt en mar, por lo que la presión de producir la cantidad smolt planificada es un constante desafío, donde el equilibrio cantidad/calidad puede sufrir desviaciones asociadas al cumplimiento de las metas de producción. Por lo expuesto anteriormente, existe consenso en la industria, respecto de que la etapa de esmoltificación cobra relevancia para el desarrollo de la industria salmonicultora chilena, donde se reconoce que existe una alta variabilidad en la calidad de los smolts que ingresa al mar en cada ciclo de producción. Una mala calidad de smolt afecta notoriamente las proyecciones productivas de las empresas. En el año 2008 se realizó las Conferencias de Agua Dulce de la compañía productora de alimento Skretting, la cual se centró en la producción de un smolt de calidad, dado que se estaba experimentando una fuerte variabilidad en el desempeño de los smolt pos ingreso al mar (Le Ruz, 2008). La disminución de desempeño mencionado por Le Ruz, corresponde a una variabilidad en la tasa de crecimiento pos ingreso (Fig.3), sumado a la alta proporción de desadaptados que se observan en algunos grupos trasladados a mar (Fig.1).
Metodología para la evaluación de la esmoltificación Para todos los salmónidos anádromos, la tolerancia a la salinidad y otros aspectos del desarrollo, que ocurren durante esmoltificación, se pierden si los peces permanecen en agua dulce (Hoar, 1988). Por lo tanto, la esmoltificación es un proceso reversible, y hay un período limitado de tiempo durante el cual los peces se encuentran preparados para la entrada a agua de mar, conocida como la “ventana fisiológica de esmoltificación”. Los límites temporales de la ventana de esmoltificación están determinados por factores ambientales que controlan tanto la estimulación como la pérdida de caracteres de individuos parr. A modo de ejemplo, la esmoltificación del salmón Atlántico se produce en primavera y se estimula principalmente por el fotoperiodo y, secundariamente, por la temperatura (Björnsson, 1997). La ventana de esmoltificación en salmón Atlántico ocurre en un periodo de tiempo de aproximadamente 35 días, a 10 °C (350 UTAs), en el cual los peces están aptos para ingresar al mar. Sin embargo, tanto el tiempo de desarrollo y los factores que la controlan, se diferencia entre los salmónidos, impulsados por la evolución de sus historias de vida (McCormick, 1994). A su vez, el desarrollo de la esmoltificación en el salmón Coho y trucha arcoíris también son impulsados por los cambios en el aumento de la duración del día, pero el fotoperiodo puede ser menos importante en el salmón pink y en el salmón chum, que desarrollan tolerancia a la salinidad poco después de la eclosión. En salmón Atlántico, Coho y trucha arcoíris, parece que la pérdida de tolerancia a la salinidad es impulsada principalmente por la temperatura y el tiempo (Zaugg y McLain 1976; Duston y col., 1991). Esta relación se ha investigado en detalle en el salmón Atlántico, donde hay una relación en forma de cúpula entre los grados-día (suma de las temperaturas medias diarias experimentada después del pico del desarrollo smolt) y la pérdida de tolerancia a la salinidad y/o la actividad de la bomba Na+K+ATPasa. Posterior a la ventana de esmoltificación, los peces que experimentan 500 grados-día se han vuelto completamente a pre-smolt o parr. También parece que la regulación de la conducta de los smolt es similar a la tolerancia a la salinidad, en que las temperaturas más altas conducen a un cese temprano del comportamiento migratorio (Wagner, 1974; Zydlewski y col., 2005) En producción, previo al traslado de los peces a agua de mar, se realiza una serie de evaluaciones y mediciones químicas y anatómicas de los smolts, con el objetivo de determinar las condiciones fisiológicas adecuadas para que los peces sean trasladados al mar. Generalmente, el rendimiento osmorregulatorio de los peces es evaluado a través de la medición de la actividad de la enzima Na+K+ATPasa.
Específicamente, esta herramienta es utilizada para evaluar la capacidad de los peces para mantener el equilibrio entre los iones Na+ y K+ celular, lo que se traduce en la capacidad de regular el balance de agua y sal bajo condiciones de salinidad elevada.
Técnicas y parámetros para definir un smolt En la edición anterior, revisamos los fundamentos fisiológicos de los salmónidos en agua dulce y salada, describimos en detalle el proceso en el cual el pez comienza sus procesos de cambios para pasar de agua dulce a agua salada (proceso de esmoltificación). Por lo tanto, en función de estos cambios, se han desarrollado índices o herramientas (ensayos de laboratorio, cambios morfológicos y conductuales) para monitorear el progreso de la esmoltificación, y poder definir en forma certera cuándo un pez parr se ha convertido en un smolt. Los productores se apoyan en estos índices para decidir si los peces se encuentran en condiciones para ser trasladados, desde las zonas de producción en agua dulce a los centros de mar. Sin embargo, la inexistencia de un indicador o índice 100% confiable, conlleva a que lotes de peces lleguen a centros de mar sin estar en óptimas condiciones fisiológicas (o con alta dispersión en la calidad de smolt), resultando en una pérdida de crecimiento, una menor eficiencia de alimentación y elevadas mortalidades por la incapacidad osmorreguladora, asociada con una mayor susceptibilidad a enfermedades contagiosas. Existe entonces, una alta necesidad por realizar investigación aplicada para establecer métodos y parámetros de medición que logren disminuir la incertidumbre respecto de la calidad del smolt. A continuación se describen y discuten las principales herramientas que permiten determinar si un pez está en condiciones de ser transferido a los centros de engorda en el mar.
Cambios conductuales En la naturaleza, un alevín parr nada contra el corriente y es territorial. Su nado contra la corriente, generalmente, es para mantener su posición y prefiere la zona más baja de la columna de agua (Handeland y col., 1996). Esta forma de nado y preferencia en la columna de agua también se observa en las pisciculturas. Una vez que el alevín parr recibe las señales ambientales que gatillan el inicio del proceso de esmoltificación, cambia su comportamiento territorial y deja de nadar contra la corriente. Esto debido a que al llegar al mar habitan en zonas profundas y adquieren un comportamiento pelágico (Handeland y col., 1996). En las pisciculturas o centros de lago, los smolt comienzan a tomar un comportamiento de nado en cardumen, errático y/o a favor de la corriente.
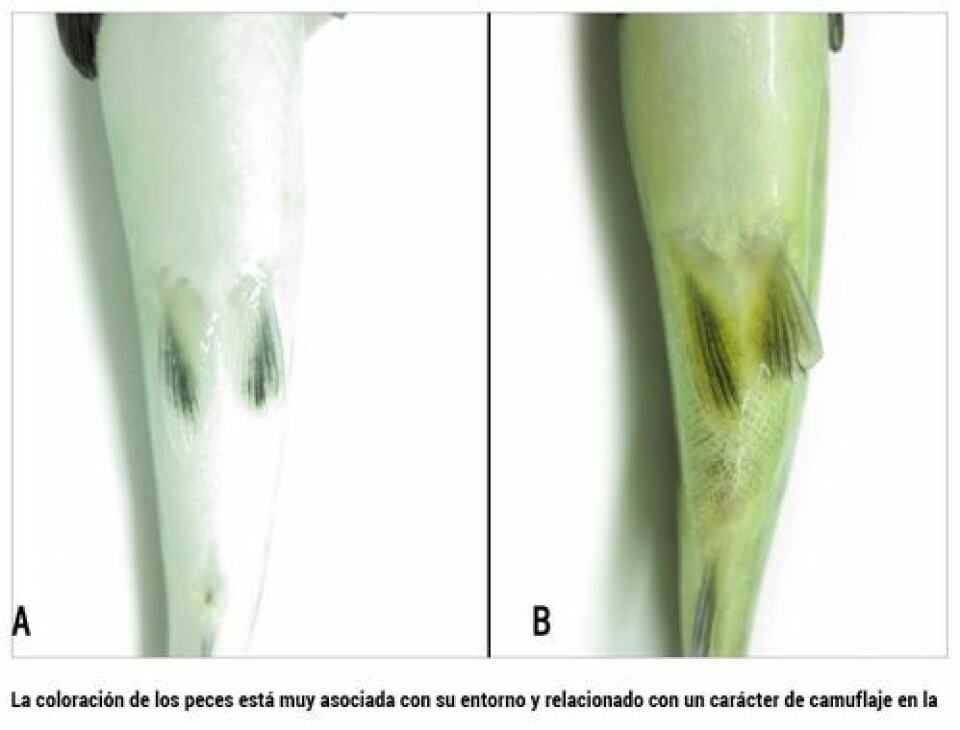
Mediciones de cambios morfológicos Coloración del pez La coloración de los peces está muy asociada con su entorno y, generalmente, relacionado con un carácter de camuflaje en la naturaleza. Es por ello que los alevines presentes en el agua dulce poseen una coloración verdosa amarillenta y presentan manchas oscurecidas verticales en los costados conocidas como “manchas parr”, mientras que un smolt toma un color azul/negro en el dorso, un tonalidad plateada en los costados y un vientre blanco. Por lo tanto, en la medida que el proceso de esmoltificación comienza en un juvenil, éste va perdiendo las manchas parr y comienza adquirir una coloración plateada, la cual está dada por la reflexión de la luz sobre la guaninas y otras purinas que comienzan su acumulación progresiva en los estratos profundos de la piel, a medida que el proceso de esmoltificación avanza (Folmar y Dickhoff, 1980). Esto, a su vez, se debe al aumento en el catabolismo proteico que está inducido por el aumento estacional de la hormona tiroidea (TSH). Por ejemplo, para validar este proceso fisiológico, se han alimentado peces parr con glándula toroide de vacuno, donde los peces parr cambian su coloración a plateados (Wedemeyer y col., 1980). Adicionalmente, se han realizado estudios en los cuales se ha utilizado la medición de guanina en piel y suero, para evaluarlos como indicadores de esmoltificación (Johnson y Eales, 1968). Otra aproximación no letal, para utilizar la coloración como indicador de esmoltificación, es un sistema de análisis de video foto reflectancia (Privas), que, en términos simples, consiste en fotografiar el costado del pez y la imagen se procesa computacionalmente para valorizar el grado de reflectancia. Sin embargo, esta metodología ha sido poco estudiada (Samon, 1999).
Coloración de las aletas Otro rasgo asociado al color distintivo entre parr y smolt es la coloración de las aletas. En los peces parr, las aletas pectorales y la aleta caudal son anaranjadas o amarillentas, y en el smolt las aletas pectorales y caudales son claras en la bases y sus bordes son más oscuros, esto debido a que en el proceso de esmoltificación ocurre una migración de melanóforos, que contienen gránulos de melanina y dan esta tonalidad a los bordes de la aleta (Mizuno y col., 2004). Estas características pueden complementar la revisión de la coloración para evaluar morfológicamente un smolt. Mucosa y escamas El pez parr que presenta una buena condición corporal exhibe escamas firmes y abundante mucosa. Esta pérdida de mucosa y la presencia de escamas más débiles, los hace más susceptibles a enfermedades de agua dulce, tales como Saprolegniosis y Flavobacteriosis. Schrock y col. (2001) estudiaron cómo fluctuaba la concentración de lisozima en el mucus durante la transformación parr-smolt en salmón Coho. La lisozima es una proteasa reconocida por su rol protector en los organismo, haciendo frente a los diversos patógenos desde su actividad proteasa. En el estudio, se pudo observar una correlación negativa, por lo que, a medida que aumentaba el proceso de esmoltificación, disminuía la concentración de lisozima en el mucus del pez. Es por este motivo que, cuando hay peces esmoltificados y que no pueden ser despachados a centros de mar por vicisitudes operativas, es común ver en dichos ejemplares la adquisición de infecciones fúngicas en corto plazo (Saprolegniosis) que, finalmente, pueden generar un estrés adicional, que va a repercutir en la adaptación final del smolt una vez traslado a mar.

Forma del cuerpo Un indicador que están asociado e influencia la forma del cuerpo, es el factor de condición (K), el cual cambia durante el proceso de esmoltificación. El factor de condición se define como: K=(peso (g)/longitud(cm)^3*100 El pez parr presenta un cuerpo redondeado y acortado. Al comenzar el proceso de esmoltificación, aumenta su tasa de crecimiento, generando un pez delgado y alargado, por lo cual se altera su factor de condición. El factor de condición de un pez parr está entre 1,2 a 1,3, generalmente, y un smolt tiene un factor de condición entre 0,9 y 1,0. Ventaja: los parámetros morfológicos son fáciles de evaluar, no requieren de personal especializado (aunque sí bien entrenado), y no necesitan de mayor equipamiento para poder evaluarlos. Se pueden generar planillas de fácil uso en las pisciculturas, que contengan graduaciones de cada uno de los parámetros discutidos anteriormente y realizar seguimientos que permitan evaluar el proceso de esmoltificación desde estas perspectivas. Desventajas: los cambios en los parámetros morfológicos son indicativos del proceso de esmoltificación. Sin embargo pueden no estar en sincronización con la ventana de esmoltificación, es decir, podríamos tener peces con aspecto redondeado y con manchas parr claras, aptos desde el punto de vista osmoregulatorio para enfrentar el desafío de traslado a mar y por otra parte tener peces plateados, oscuro en el dorso, con aletas oscurecidas en los bordes y deficientes en capacidad osmorreguladora pos traslado a mar. Incluso, existe un reporte en cual se observan diferencias en algunos de estos parámetros morfológicos entre smolt de uno y dos años (Dêbowski y col., 1999). Por este motivo, el seguimiento de estos parámetros en la esmoltificación es válido, pero requieren de ensayos complementarios para definir si el pez ha adquirido las capacidades osmoregulatorias.
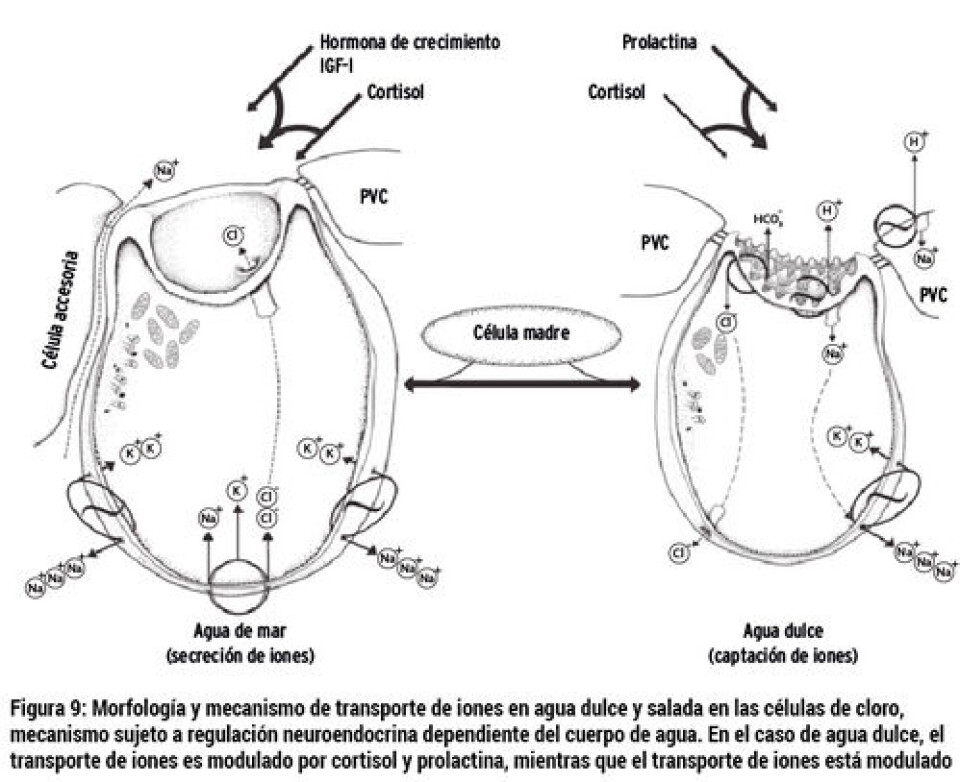
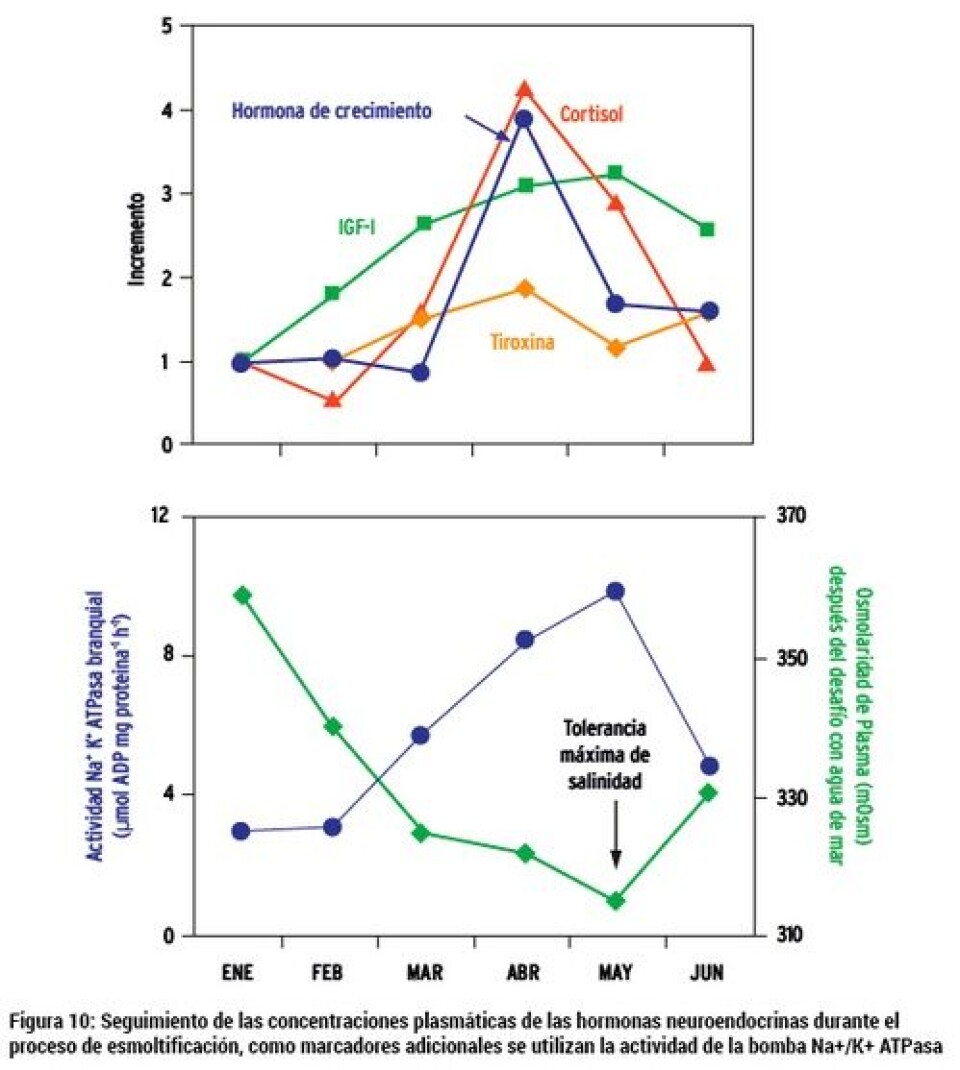
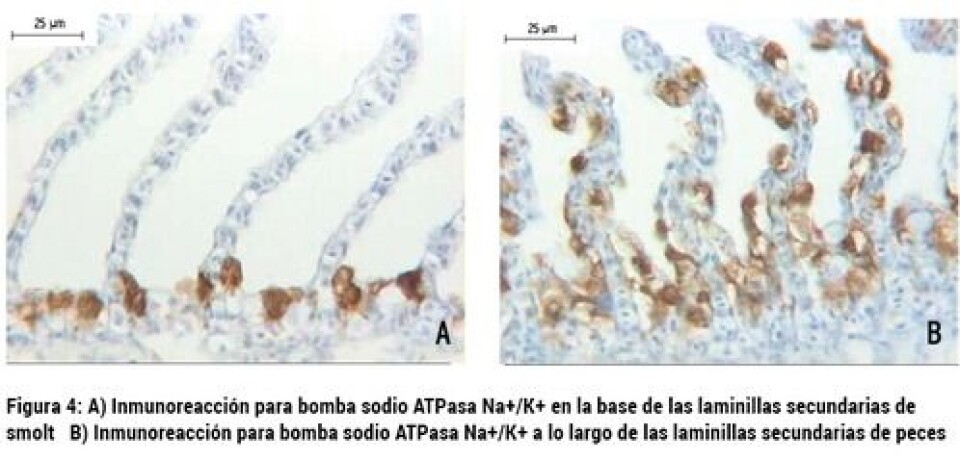
Medición del sistema neuroendocrino Es reconocido el rol crítico que juega el sistema neuroendocrino en la relación entre los estímulos ambientales que gatillan el proceso de esmoltificación y la respuesta fisiológica asociada a la misma (Fig. 9, McCormick y col., 2001). Está descrito que tanto el cortisol, el eje hormona de crecimiento (GH)/factor de crecimiento tipo insulina I (IGF-I), y las hormonas tiroideas (T3 y T4), subyacen los mecanismos fisiológicos necesarios para la adaptación en agua de mar. En tanto, la prolactina y cortisol están asociados por modular la captación de iones en agua dulce. El Cortisol, por lo tanto, sería clave tanto en la adaptación de agua dulce como en agua mar (McCormick, 2011). En la Figura 10 se puede apreciar cómo estas hormonas se comportan e interaccionan durante el proceso de esmoltificación, utilizando como marcador la osmolaridad del plasma y la actividad de bomba Na+/K+ ATPasa. De este modo, el uso de estas hormonas como herramienta de medición para evaluar el progreso de la esmoltificación es válido. Existen algunos estudios donde se han utilizado estas hormonas asociadas con otros marcadores, para seguir el proceso de esmoltificación. Estas moléculas son medidas a partir del plasma de los peces (Jørgensen y col., 2007; McCormick y col., 2013b). Ventaja: el uso de los marcadores neuroendocrinos tiene como ventaja complementarse con otros marcadores de uso común en la evaluación del proceso de esmoltificación. Con esta integración, se pueden evaluar los estímulos endocrinos con los resultados en los cambios fisiológicos que se van produciendo en el pez. Desventajas: al igual que en la medición de la actividad de la bomba Na+/K+ ATPasa e inmunohistoquímica, se requiere de infraestructura especializada, así como de profesionales capacitados para llevar a cabo este tipo de mediciones. El cortisol, que es una de las moléculas importantes en la modulación, es muy sensible al estrés del pez. Por este motivo, una mala toma de la muestra (asociada con un alto estrés para tomar la muestra) podría alterar el resultado. En nuestro país existen pocas instancias y bases de datos asociados con estas hormonas en el seguimiento del proceso de esmoltificación. Inmunohistoquímica La inmunohistoquímica es un ensayo de laboratorio que combina técnicas histológicas y de inmunodiagnóstico. Esta última se fundamenta en reacciones de antígeno-anticuerpo. La realización de este ensayo consiste en evaluar el posicionamiento de las células de cloro en la branquia usando, como marcador de éstas, la bomba Na+/K+ ATPasa. Como comentamos anteriormente, Na+/K+ ATPasa es una enzima clave en el mantenimiento de la homeostasis del organismo. En agua dulce, las células de cloro se ubican a lo largo de todas las laminillas secundarias de la branquia, mientras que en el pez que se encuentra esmoltificado, se ubica sólo en la base de las laminillas secundarias (Fig.4). Existen varios estudios que utilizan esta metodología para estudiar la localización de las células de cloro en la branquia en peces (McCormick y col., 2009; McCormick y col., 2013; Pastor y col., 2008; Shen y col., 2007). En forma breve, para realizar este ensayo, se toman muestras en terreno de branquias de peces en los que se monitoreará su grado de esmoltificación. Se toma el primer o segundo arco branquial y se deposita en formalina bufferizada al 10% para fijar la branquia (durante al menos 12 h). Posterior a este tiempo, se procede a realizar el procesamiento histológico de rutina, para incluir la branquia en un bloque de parafina. De este bloque, se generan cortes que se depositan en un portaobjeto pre tratado para poder llevar a cabo una reacción de antígeno-anticuerpo. Se utilizan anticuerpos para algún antígeno que constituye la bomba Na+/K+ ATPasa. Finalmente, se ocupa un sistema cromogénico comercial para revelar la reacción de antígeno anticuerpo, y se utiliza un colorante de contraste para evidenciar la morfología de la branquia y evidenciar el posicionamiento de las células de cloro. De esta forma, se determina por observación al microscopio la ubicación de las células de cloro, revelada por la bomba Na+/K+ ATPasa El tiempo de este ensayo en el laboratorio va generalmente desde las 48 a 96 h, dependiendo de los procedimientos empleados y disponibilidad del personal para ejecutar el procedimiento de laboratorio. Ventaja: este ensayo permite tener una evidencia visual de cómo las células de cloro comienzan a migrar en el tejido branquial debido al proceso de esmoltificación. Es un ensayo robusto, dado que existe una alta correlación entre el posicionamiento de las células de cloro con la capacidad osmótica del pez, tanto en agua dulce como en agua de mar. Otra ventaja es que la interpretación de este resultado no es muy compleja, dado que sólo hay que clasificar el posicionamiento de las células de cloro. Desventajas: se requiere del equipamiento de histología, que es costoso y requiere instalaciones que cuenten con extractores de gases para llevar a cabo el ensayo. Además, contar con personal profesional entrenado y capacitado para el procesamiento de la muestra.
Pruebas de enzima - ATPasa De las pruebas de laboratorio, la medición de la actividad de la bomba sodio ATPasa Na+/K+ es la más robusta y ampliamente usada por los productores de smolt. Corresponde a la medición “in vitro” de la actividad de la bomba Na+/K+ ATPasa. Está presente en altas concentraciones en todos los tejidos que transportan sal, tales como riñones en los vertebrados, glándulas de sal en aves, glándula rectal de tiburones y las células de cloro en teleósteos (McCormick, 1993). En las células de cloro, la bomba Na+/K+ ATPasa tiene como función generar un gradiente electroquímico en las células de cloro para que ésta pueda expulsar sales (cloruro, principalmente). Es por este motivo que la actividad de esta enzima se utiliza como marcador de la transformación parr-smolt en los laboratorios que evalúan esmoltificación. Como se mencionó anteriormente, el pez parr comienza un proceso en el cual se prepara para pasar de un ambiente hipotónico a uno hipertónico. Por lo tanto, este método revela la cantidad y eficacia de la enzima que impulsa la sal en las células de cloro. De este modo, la capacidad de los peces para deshacerse de las sales está directamente relacionada con la cantidad y eficacia de la bomba Na+/K+ ATPasa, por lo que éste método entrega información con un alto grado de precisión. Dado que esta prueba es una medición de actividad enzimática, se deben tomar las muestras de branquias en terreno (primer o segundo arco branquial) y almacenarlos en nitrógeno líquido para su transporte al laboratorio. Existen varias metodologías para determinar esta actividad, pero aquí revisaremos las dos más utilizadas. En términos generales, ambos ensayos comparten un similar comienzo del procedimiento, con sutiles desviaciones que consisten en generar un homogenizado de branquias en algunos buffers y pasos de centrifugación apropiados, para tener un crudo u homogenizado con actividad ATPasa. Ambas aproximaciones experimentales se basan en la utilización un inhibidor de la bomba Na+/K+ ATPasa llamado oubaina. La branquia, como un tejido complejo, posee en las membranas de su epitelio varios tipos de bombas proteicas ATPasa, lo que significa que son capaces de hidrolizar el ATP (Adenosin Trifosfato) a ADP (Adenosin Difosfato) y de ahí el nombre ATPasa. Además, utilizan la energía liberada en la hidrolisis de ATP a ADP para llevar a cabo sus funciones de transporte en las membranas celulares. Por lo tanto, si colocamos ATP en un homogenizado de branquias podríamos medir la actividad ATPasa total de la branquia, ya que existen varias bombas ATP en la branquia. Dado que a nosotros nos interesa medir sólo la actividad específica de la bomba Na+/K+ ATPasa, a partir de cada homogenizado se generan dos mediciones de actividad ATPasa, una reacción con oubaina y sin oubaina. De esta forma, si restamos la actividad ATPasa del tubo con oubaina al que no tiene oubaina, obtenemos la actividad específica de la Na+-K+ ATPasa. La diferencia entre las dos aproximaciones, es la forma de cómo se mide la actividad ATPasa. El primer método, descrito por Zaugg en 1982, determina la actividad de la bomba Na+/K+ ATPasa por medio de la medición de fósforo inorgánico generado al hidrolizarse el ATP, reacción en la cual se genera ADP y Pi (fósforo inorgánico). En tanto, McCormick describió una metodología que utiliza tres reacciones enzimáticas para medir la actividad ATPasa (Fig.5). En ambas metodologías, la reacción de hidrolisis de ATP es por un tiempo determinado (10 min, generalmente). Se detiene la reacción y se mide la actividad, en términos simples. Para un mayor detalle se pueden revisar los protocolos en las referencias. Adicionalmente, de cada crudo se mide la concentración de proteínas, dado que la actividad está expresada por µmoles ADP hidrolizado/mg de proteína/hora en el caso de McCormick, (1993) y en el caso de Zaugg (1982) se expresa por µmoles Pi hidrolizado/mg de proteína/hora. Tanto para la determinación de ADP, Pi y proteínas, se utilizan curvas de calibración y controles de calidad adecuados para controlar los respectivos procedimientos. Para un mayor detalle de los respectivos procedimientos, revisar las publicaciones originales. Como resultado de los ensayos, la metodología descrita por Zaugg define para peces parr actividades de Na+/K+ ATPasa de 5 a 10 µmoles Pi hidrolizado/mg de proteína/hora y de 12 a 65 para smolt. Mientras que la metodología descrita por McCormick define a un parr con actividad de Na+/K+ ATPasa de 3,7±0,5 µmoles ADP hidrolizado/mg de proteína/hora y para un smolt la actividad de 15,2± 1,6. Ventajas: la mayor ventaja es su poca sensibilidad al estrés, la aplicación sin necesidad de un grupo de peces separado del manejo habitual y su precisión. Además, el ensayo es reconocido por los productores de smolt por su fiabilidad para determinar los grados de esmoltificación. Desventajas: para realizar esta metodología se ocupa equipamiento e infraestructura especializada, tanto a nivel de laboratorio y como en terreno, por lo cual, se requiere de un alto nivel de inversión para llevar a cabo este ensayo. Se necesita, además, de un profesional calificado que maneje el proceso que ejecuta y que sea capaz de llevar los cálculos correspondientes. También se considera una desventaja menor el hecho que para tomar la muestra de branquia se tenga que, generalmente, sacrificar al pez. También se podría tomar una biopsia, sin embargo, esto requiere de personal con mayor entrenamiento y equipamiento más sofisticado (Electrobisturí). Dado que existen distintas aproximaciones para medir la actividad de la bomba Na+/K+ ATPasa, los laboratorios pueden realizar distintos ensayos para llegar a evaluar el grado de esmoltificación y no ser comparables los resultados de un laboratorio frente a otro, a menos que usen la misma metodología, reactivos y equipamiento. Por este motivo, los productores deben realizar sus seguimientos de grupos de peces con un único laboratorio para tener resultados comparables en el tiempo.
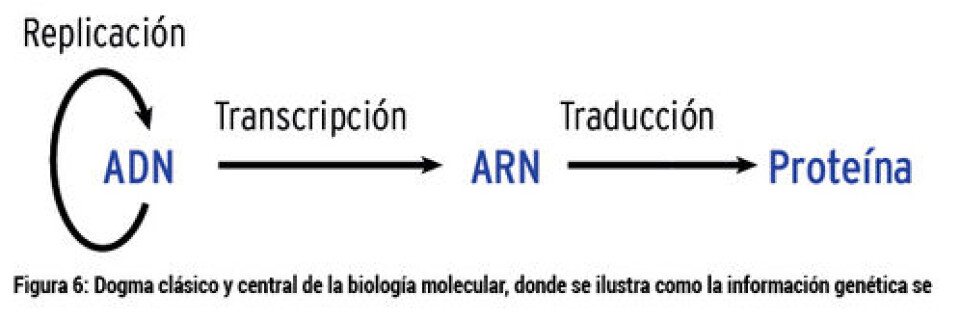
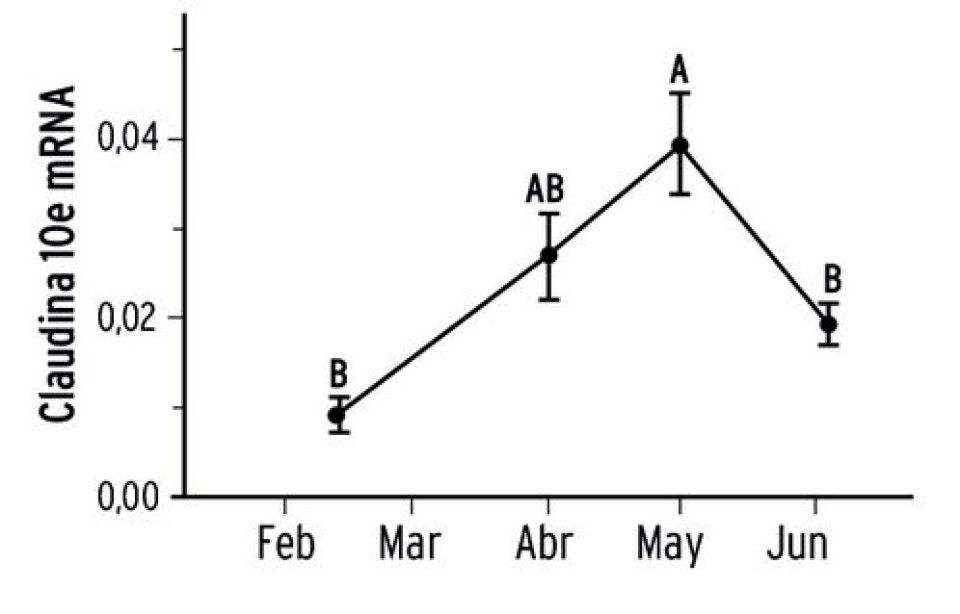
Marcadores moleculares asociado con la esmoltificación La genómica es definida como el conjunto de ciencias y técnicas dedicadas al estudio integral del funcionamiento, el contenido y la evolución de un genoma (la totalidad de información genética de un organismo en particular). Las herramientas genómicas han estado en constante desarrollo en los últimos diez años, como consecuencia de los avances realizados en biología molecular e informática. En acuicultura, la genómica ha aportado las primeras aproximaciones para describir rutas celulares y los genes que se encuentran involucrados en el desarrollo de diversos fenómenos fisiológicos. Es así que, ya en el año 1994, diversos estudios sugerían que el proceso de transformación parr-smolt se encontraba bajo un control genético (Nielsen y col., 2007), pero, ¿qué significa esto?; primero, hay que revisar un concepto clásico que corresponde a un dogma de la biología molecular (Fig.6), del cual nos referiremos sólo a cómo la información que se encuentra en los genes termina en un producto (proteínas), desde la perspectiva clásica. En el ADN se encuentra toda la información para sintetizar los distintos productos que hay en las células, mientras que las estructuras donde se sintetizan las proteínas se llaman ribosomas. Sin embargo, la información contenida en al ADN no pasa directamente a los ribosomas, sino que lo hace a través del RNA mensajero (proceso denominado transcripción y, coloquialmente, nos referimos a que se están expresando los genes), luego, este RNA mensajero se va a los ribosomas para que se sinteticen las proteínas (proceso denominado traducción). Hemos revisado la función de la bomba Na+/K+ ATPasa, que es una proteína, y hay genes que tienen la información para poder sintetizarla. Cuando comienza el proceso de transformación parr-smolt los genes involucrados en la síntesis de la bomba de Na+/K+ ATPasa comienzan a expresarse en mayor cantidad. Por lo tanto, habrá muchas copias de RNA mensajeros para genes de la Na+/K+ ATPasa de mar. Estas moléculas mensajeras se pueden cuantificar en forma absoluta o relativa, pero con ambas mediciones se puede cuantificar la expresión de los genes (entonces en el laboratorio se mide el proceso de transcripción). Si podemos medir cómo estos genes se están activando, para generar los productos necesarios en un proceso fisiológico, podemos usarlos como marcadores moleculares para evaluar el proceso, en nuestro caso la transformación parr-smolt. Con las herramientas genómicas actuales, se puede caracterizar el transcriptoma (la totalidad de los RNA mensajeros expresando en un momento determinado). Es así, que se han realizados estudios en los que se ha caracterizado el transcriptoma de salmón Atlántico durante el proceso de esmoltificación, por lo que podemos disponer de todos los genes que se están “prendiendo” y “apagando” durante este proceso (Seear y col., 2010). En este estudio, se puede observar cómo los genes se activan en distintos órganos asociados con el proceso de osmorregulación, y se pueden seleccionar genes específicos que serán utilizados como marcadores para monitorear la transformación parr-smolt. A partir de estos estudios, se pueden seleccionar genes específicos. Por ejemplo, Tipsmark y col. (2011) estudiaron la expresión de unas proteínas en branquias asociadas con la unión celular, denominadas claudinas. En el estudio pudieron ver cómo se expresaban los genes de estas claudinas durante el proceso de esmoltificación (Fig.7; Tipsmark y col., 2011). En función de estos resultados, en el laboratorio tratamos de replicar esta experiencia. Para esto, montamos un sistema de expresión de la claudina 10e y usamos la medición enzimática de la bomba Na+/K+ ATPasa para realizar el seguimiento de la transformación parr-smolt (Fig. 8). En el seguimiento realizado a un grupo con fotoperiodo artificial, podemos ver que los resultados demuestran cómo la actividad de la bomba Na+/K+ ATPasa comienza a incrementarse a medida que el pez comienza adquirir las competencias osmoreguladoras. En relación con la expresión del gen que codifica la proteína claudina 10e, se puede observar como en el tercer muestreo hay un aumento de la expresión en comparación a los dos primeros muestreos. Los posteriores, tercer y cuarto muestreo, presentan el mismo nivel de expresión. Por lo tanto, no tenemos un incremento de la expresión, sólo tenemos dos niveles de expresión en los cuales uno se podría interpretar como no esmoltificado y el otro como esmoltificado. Sin embargo, estas aproximaciones deben ser validadas para su uso en terreno en forma rutinaria. Existen diversos estudios donde se investiga la expresión de los genes de interés asociados con marcadores clásicos, con el objetivo de conocer cómo varían en el proceso de transformación parr-smolt (Bystriansky y col., 2011). Ventaja: se puede estudiar en forma específica el proceso fisiológico que uno desee, dado que se conoce un gran porcentaje de los genes de especies salmonideas y, por lo tanto, se pueden diseñar estrategias para conocer la dinámica de expresión de los genes de interés. Desventajas: se requiere equipamiento e infraestructura especializada, por lo cual, se necesita de un alto nivel de inversión para llevar a cabo este ensayo. Se requiere, además, de un profesional calificado que maneje el proceso que ejecuta y que sea capaz de llevar los cálculos correspondientes a los ensayos de expresión génica.
Electrólitos plasmáticos Más del 90 % de la presión osmótica (índice clave para la osmorregulación) en la sangre de los peces se encuentra en función de las concentraciones de los iones Na+ y Cl-. Si un pez se encuentra en agua dulce o salada, debe mantener la homeostasis respectiva. Un indicador de esta homeostasis, corresponde a la medición de la osmolaridad del plasma. Se ha descrito que, para peces teleósteos, debe haber una osmolaridad plasmática entre un rango de 300-400 mOsm (miliosmol). Para salmón Atlántico, la osmolaridad del plasma es de 328 y 344 en agua dulce y salada, respectivamente (Parry y col., 1961). En relación con los rangos de los principales electrolitos que definen la osmolaridad del plasma, se estableció para los géneros Salmo y Oncorhynchus que el rango del Na+ es 133-155 mEq/; Cl- es 111-135 mEq/l; y K+ es 3-6 mEq/L (Folmar y Dickhoff, 1980). Las concentraciones de estos electrolitos varían en la fase aguda de la transferencia a agua de mar (primeras 36 a 100 h pos traslado). Es por este motivo que los electrolitos plasmáticos pueden ser utilizados como marcadores de esmoltificación. Si los peces que han sido trasladados a mar y han pasado la fase aguda, siguen presentando niveles altos de electrolitos, se puede concluir que éstos no habían desarrollado su capacidad osmorreguladora en forma completa cuando fueron trasladados. Se esperaría de un ejemplo como éste, que el grupo presente altos índices de mortalidad y comportamiento errático. Ventajas: es una técnica sencilla de ejecutar, ya que sólo hay que ingresar la muestra de plasma al equipo y éste arroja los valores. Es un ensayo muy robusto si se combina con el desafío salino (ver más adelante), ya que se puede evaluar si los peces pos desafío pueden osmorregular hasta llegar a los valores de referencia de osmolaridad. Desventajas: para realizar esta metodología, se requiere equipamiento mínimo y un profesional calificado que maneje el proceso que ejecuta para poder liberar los resultados en forma correcta. Dado que el pez tiende a mantener su homeostasis, las variaciones de la osmolaridad en plasma y las concentraciones de electrolitos que definen esta osmolaridad presentan variaciones pequeñas que podrían no ser fuertes señales para definir si un smolt se ha desarrollado en forma completa. Los cambios bruscos sólo se dan en la fase aguda pos traslado, pero esta medición no es muy útil si el grupo no tuvo un buen proceso de esmoltificación, ya que una vez en agua de mar no soportan el desafío. Es por este motivo que esta técnica se complementa con el desafío salino.
Desafío salino Este ensayo simple fue desarrollado por Clarke y Blackburn en 1977 para estudiar la adaptabilidad de salmón Coho al agua de mar. La metodología es bastante práctica y consiste en trasladar peces a una unidad experimental, donde se pueda desarrollar este test. Los peces son mantenidos entre dos a tres días en adaptación sin alimentación, con temperatura y fotoperiodo ambiental. Posterior a esto, una fracción de los peces son transferidos a agua salada (29-30 ppm) y mantenidos durante 24 h sin manipulación adicional. Finalizado este tiempo, se evalúa la supervivencia del grupo, se anestesian los peces para poder tomar una muestra de sangre y poder evaluar la capacidad osmorreguladora que éstos presentan, mediante la medición de sodio plasmático. Un valor de referencia de sodio es 170 mmol/L, por lo que, peces que presenten valores de sodio cercanos o inferior a 170 mmol/L estarían adaptados a un ambiente marino (Blackburn y Clarke, 1987). Sin embargo, los resultados de este tipo de ensayo son muy dependientes del manejo, ya que, como revisamos, los procesos de estrés pueden afectar la regulación del proceso de esmoltificación. Ventaja: es una prueba de campo que permite evaluar en forma directa si los peces presentan capacidad osmorreguladora, debido a que son sometidos a agua de mar en formato in vivo. Desventajas: se requiere manipular los peces, por lo cual los resultados de la experiencia de desafío podrían estar influenciados por el nivel de estrés que se genere el manejo.
Chequeos sanitarios Existe poca literatura en relación al efecto de la presencia de patógenos de salmones asociados al proceso de esmoltificación, en el cual, la presencia de una bacteria o virus en estado latente puede activarse como consecuencia del proceso de estrés que conlleva el traslado de los peces y la adaptación al agua de mar, resultando en pérdidas directa pos traslado. En una prueba experimental, peces de la especie salmón Coho que se encontraban con una carga baja de la bacteria Renibacterium salmoninarum (agente causal de la Enfermedad Bacteriana del Riñón; BKD por su sigla en Inglés) se dividieron en dos grupos de peces, el primer grupo fue transferido a un estanque de agua dulce y, el segundo grupo, trasladado a agua de mar. Como resultado de esta experiencia se pudo observar que peces trasladados al mar tenían 12 puntos de diferencia en mortalidad acumulada (Wedemeyer y col., 1980). Otro estudio sobre el mismo modelo presenta resultados similares (Sander, 1979). Por lo tanto, peces con infecciones subclínicas pueden tener mortalidad pos transferencia en forma directa. En Chile se han reportado casos de Necrosis Pancrática Infecciosa, causada por el patógeno endémico IPNv en peces transferidos al mar. Por este motivo, se considera que el estatus sanitario de los peces que van a trasladarse al mar debe ser óptimo, para no tener pérdidas asociados a patología pos transferencia. (Rønneseth y col., 2007). Dados estos antecedentes, siempre se debe realizar un chequeo sanitario antes de trasladar a los peces, y así evitar posibles problemas sanitarios pos ingreso. Ventaja: permite definir si el pez es portador de algún patógeno en particular, que pudiera repercutir en el desafío de adaptación en la fase de engorda. Es por este motivo que, cada grupo de alevines que se prepare para esmoltificar, debe ser monitoreado sanitariamente. Desventajas: se requiere contratar el servicio en laboratorios acreditados, lo que conlleva un costo extra para la producción. Sin embargo, este costo no es relevante cuando se tienen problemas sanitarios en el proceso de esmoltificación y adaptación en mar.
Comentarios Finales La transferencia de peces con una disminuida preparación a las condiciones de agua mar puede generar grandes pérdidas económicas a corto plazo, expresada en mortalidades masivas de peces que no estaban adaptados para las condiciones de mar y pérdidas económicas a largo plazo, asociadas con peces desadaptados que no convertirán el alimento entregado. Estos últimos, generalmente presentan una disminuida condición corporal y, además, son fuente de reservorio para infecciones que pudieran afectar a toda la población. Es por ello que las compañías que producen smolts han generado matrices de puntación de las distintas características y parámetros que definen un smolt, generalmente conocidos como “Smolt Index” y, con ellos, pueden elaborar puntos de cortes que faciliten la toma de decisiones para el traslado de peces al mar. Históricamente, cada compañía ha creado su propia matriz de Smolt Index, ajustada a sus condiciones de cultivo. Sin embargo, en el año 2013, por una iniciativa coordinada por AVS Chile y algunas compañías productoras (Blumar, Camanchaca, Marine Harvest, Multiexport Foods y Ventisqueros) se gestó el proyecto “Evaluación de los parámetros usados en el índice de calidad de smolt por empresas chilenas productoras de salmónidos” con el fin de profundizar en el conocimiento de la esmoltificación por medio del intercambio de experiencias y conocimientos enfocados en la evaluación del índice de calidad de smolt y parámetros de esmoltificación de uso en la industria. Por lo tanto, dada la relevancia de generar un buen smolt como materia prima para la fase de engorda se hace necesario incorporar programas internos en las empresas dirigidos al aseguramiento de la calidad del smolt. Estos programas deben ser dirigidos en una adecuada planificación de producción de smolt en relación a los planes de cosecha, seguimiento y control del proceso de esmoltificación por medio de los índices de calidad de smolt que permitan asegurar la capacidad osmorreguladora del pez, y así comenzar la fase de engorda con un smolt de calidad que haga frente a sus nuevos desafíos de esta etapa. Sin embargo, en esta revisión sólo hemos abordado índices de terreno y laboratorio que permiten establecer la transformación parr-smolt desde el punto de vista de desarrollo de las capacidades osmorreguladoras del pez para su adaptación al agua de mar, por lo que quizás estas herramientas deberían definir sólo calidad de smolt, desde un punto de vista osmoregulatorio. El proceso de esmoltificación productiva (4 a 6 semanas) representa sólo la etapa final de la producción del smolt. Para discutir sobre la calidad del smolt en términos integrales se hace necesario revisar, adicionalmente, todos los procesos de la fase de agua dulce, desde la reproducción que genera los gametos, hasta el comienzo del proceso de esmoltificación, para complementar los índices que van a definir un smolt de calidad, en relación con sus expectativas productivas. Dentro de los parámetros a analizar están: la cepa utilizada (genética); las Unidades Térmicas Acumuladas (UTAs) que posee el smolt a su salida al mar (podrían haber UTAs óptimas por cepas);la densidad a la que fue cultivado el smolt en sus estadios anteriores; el número de tratamientos sanitarios que tuvo; su historial sanitario; el tipo de piscicultura; la alimentación (calidad de alimento y estrategia de entrega); vacunación, manejos, etc., temas que serán abordados en los próximos capítulos de Aprendiendo Acuicultura. Por lo tanto, la producción de smolt es un desafío complejo y constante, por ello, los índices de calidad de smolt deben estar en constante evaluación y validación.
Referencias Para revisar la literatura citada puede descargarla desde https://www.salmonexpert.cl/?page_id=221




















